W.X.Y.Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3:8;X的核外电子总数与Y的最外层电子数相等,X的原子 序数是Z的原子序数的一半;W.Y.Z位于同一周期。
序数是Z的原子序数的一半;W.Y.Z位于同一周期。
(1)W的单质是一种 色晶体。
(2)W.Y.Z三种元素的气态氢化物稳定性由高到低的顺序是 (用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似)。
(3)用化学方程式证明元素原子的得电子能力Y强于W
(4)Y的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种 稀溶液,并放出QkJ的热量,写出该反应的热化学方程式 。
稀溶液,并放出QkJ的热量,写出该反应的热化学方程式 。
(5)已知A.B.C.D四种物质存在如下反应关系: A+B C+D
C+D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是 。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是 。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气 造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是 。
造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是 。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1∆H < 0(I)
NaNO3(s)+ClNO(g) K1∆H < 0(I)
2NO(g)+Cl2(g) 2ClNO(g) K2∆H < 0 (II)
2ClNO(g) K2∆H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向 2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内V(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得 1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数Ka=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
| A.向溶液A中加适量水 | B.向溶液A中加适量NaOH |
| C.向溶液B中加适量水 | D.向溶液B中加适量NaOH |
(4)在25℃下,将a mol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显 (填“酸”“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离常数Kb= 。
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:
HClO:Ka=3×10﹣8 HCN:Ka=4.9×10﹣10 H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10﹣11
84消毒液(有效成份为NaClO)中通入少量的CO2,该反应的化学方程式为 。
(1)室温下,有一pH=12的NaOH溶液100mL,欲使它的pH降为11。
①如果加入蒸馏水,就加入________mL
②如果加入pH=10的NaOH溶液,应加入_________mL
③如果加入0.008mol/LHCl溶液,应加入__________mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式,为了防止Al2(SO4)3发生水解,可加入少量的。
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+)。
| 金属离子 |
pH值 |
|
| 开始沉淀 |
完全沉淀 |
|
| Fe2+ |
7.6 |
9.6 |
| Cu2+ |
4.4 |
6.4 |
| Fe3+ |
2.7 |
3.7 |
实际生产中先用次氯酸钠将Fe2+氧化成Fe3+,然后用试剂将溶液pH值调至 ~ ,即可除去铁杂质。
将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
| HI体积分数 |
1min |
2min |
3min |
4min |
5min |
6min |
7min[ |
| 条件I |
26% |
42% |
52% |
57% |
60% |
60% |
60% |
| 条件II |
20% |
33% |
43% |
52% |
57% |
65% |
65% |
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H__________0(填">","<"或"=")
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g) CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。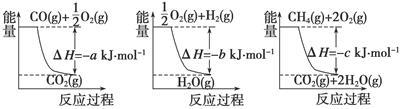
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式: 。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的正极电极反应式是__________________。
(4)利用右图装置可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。
假设海水中只有NaCl溶质,写出此时总离子反应方程式:
②若X为锌,开关K置于M处,该电化学防护法称为 。写出铁电极处的电极反应式:____________。
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用酚酞作指示剂。请填写下列空白:
(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果________(填“偏高”、“偏低”或“无影响”)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察____________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
(3) 滴定结果如下表所示:
| 滴定次数 |
待测溶液NaOH的 体积/mL |
标准盐酸溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.11 |
| 2 |
25.00 |
1.56 |
30.30 |
| 3 |
25.00 |
0.22 |
26.31 |
若盐酸标准溶液的浓度为0.1000 mol·L-1,则该NaOH溶液的物质的量浓度为_________ mol·L-1。