下图中A、B、C、D、E、F、G均为有机化合物。
(1)D的化学名称是 。
(2)反应③的化学方程式是: 。
(3)B的分子式是 ,A的结构简式是: ,  反应①的反应类型是 。
反应①的反应类型是 。
(4)符合下列三个条件的B的同分异构体的数目有 个。
①含有邻二取代苯环结构;②与B具有相同的官能团;③不可与FeCl3溶液发生显色反应。写出其中所 有同分异构体的结构简式(如果答题纸上的空格不够,请自己补填完整):
有同分异构体的结构简式(如果答题纸上的空格不够,请自己补填完整):
(5)G是重要的工业原料,用化学方程式表示G的一种重要工业用途
。
2008年9月,我国爆发了三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,经调查发现三鹿牌婴幼儿配方奶粉中加入了有毒的三聚氰胺(化学式为 C3N3(NH2)3)牛奶和奶粉都要按规定检测蛋白质的含量,通用的蛋白质测试方法是“凯氏定氮法”,即通过测出含氮量来估算蛋白质含量。牛奶和奶粉添加三聚氰胺,主要是因为它能提高含氮量,冒充蛋白质。
(1)三聚氰胺相对子质量是_______。其含氮的质量分数为_______。
(2)各个品牌奶粉中蛋白质含量为15-20%,蛋白质中含氮量平均为16%。以某合格奶粉蛋白质含量为18%计算,含氮量为2.88%。如果三鹿牌奶粉1袋(400 g)中加了1 g三聚氰铵,相当于蛋白质含量增加了 %
某有机物A的蒸气与相同状况下同体积H2的质量比是30,其分子中碳、氢的质量分数分别是40%、6.6%,其余均为氧,则该有机物的分子式为。
(1)写出硬脂酸甘油酯发生皂化反应的化学方程式:
(2)写出葡萄糖在酒化酶的作用下转化为酒精的方程式:
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)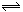 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。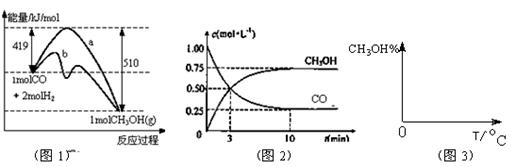
请回答下列问题:
(1)在“图1”中,曲线(填a或b)表示使用了催化剂;该反应属于(填吸热、放热)反应。
(2)下列说法正确的是
| A.起始充入的CO为1mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小 |
(3)从反应开始到建立平衡,v(H2)=;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ;ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式。
有pH均为2的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是:(用“>、<、=”表示,下同)。
(2)取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是:。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是:。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应过程中放出H2的速率依次为a1、a2、a3,则其关系是:。