下述做法能改善空气质量的是
| A.以煤等燃料作为主要生活燃料 |
| B.鼓励私人购买和使用汽车代替公交车 |
C.利用太阳能、风能 和氢能等能源替代化石能源 和氢能等能源替代化石能源 |
| D.限制使用电动车 |
下列化学用语正确的是
| A.聚丙烯的链节:—CH2—CH2—CH2— |
B.二氧化碳分子的比例模型: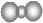 |
C.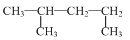 的名称:1,3—二甲基丁烷 的名称:1,3—二甲基丁烷 |
D.氯离子的结构示意图: |
化学与人们的日常生活密切相关,下列叙述正确的是
| A.二氧化硅是制造玻璃、光导纤维的原料 |
| B.纤维素、油脂是天然有机高分子化合物 |
| C.白菜上洒少许福尔马林,既保鲜又消毒 |
| D.NOx、CO2、PM2.5颗粒都会导致酸雨 |
关于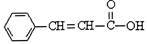 的下列说法中正确的是
的下列说法中正确的是
| A.分子式为C9H9O2 |
| B.含有三种官能团 |
| C.可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 |
| D.可以发生取代反应和加成反应,但不能发生聚合反应 |
下列对事实的解释或结论不正确的是
若要产生一定量的氯气,下列物质分别与足量浓盐酸反应,消耗的物质的量最少的是
| A.KMnO4 | B.KClO3 | C.MnO2 | D.Ca(ClO)2 |