下列关于制取硝酸铜的三种方案(原理)的叙述中,正确的是
①2Cu+O2 2CuO, CuO+2HNO3=Cu(NO3)2+H2O;
2CuO, CuO+2HNO3=Cu(NO3)2+H2O;
②3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O;
3Cu(NO3)2+2NO↑+4H2O;
③Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
| A.三方案中所涉及的反应都属于氧化还原反应 |
B.三 方案中硝酸的利用率②>①>③ 方案中硝酸的利用率②>①>③ |
| C.制取相同量的硝酸铜②产生的有害气体比③多 |
| D.三种方案中①方案最优 |
对于可逆反应H2(g)+I2(g) 2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是
2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是
①H2(g)的消耗速率与HI(g)的生成速率之比为2∶1 ②反应进行的净速率是正、逆反应速率之差 ③正、逆反应速率的比值是恒定的 ④达到平衡时,正、逆反应速率相等
| A.①② | B.②④ | C.①④ | D.③④ |
下列电离方程式中正确的是
A.NaHSO4溶于水:NaHSO4 Na++H++SO42- Na++H++SO42- |
| B.次氯酸电离:HClO===ClO-+H+ |
C.HF溶于水:HF+H2O H3O++F- H3O++F- |
D.NH4Cl溶于水:NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
工业生产水煤气的反应为:C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
| A.水煤气反应中,生成1molH2(g)吸收131.4 kJ热量 |
B.CO(g)+H2(g) C(s)+H2O(g)ΔH=+131.4kJ·mol-1 C(s)+H2O(g)ΔH=+131.4kJ·mol-1 |
| C.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
| D.反应物能量总和大于生成物能量总和 |
在298K、101kPa时,已知:
(1)2H2O(g)= O2(g)+2H2(g) ΔH1
(2)Cl2(g)+H2(g)=2HCl(g) ΔH2
(3)2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
某化学反应的能量变化如图所示。下列有关叙述正确的是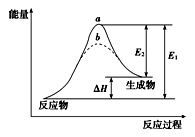
| A.逆反应的活化能小于正反应的活化能 |
| B.a、b分别对应有催化剂和无催化剂的能量变化 |
| C.该反应的反应热ΔH=E2-E1 |
| D.催化剂能改变反应的焓变 |