(Ⅰ)本世纪是生命科学研究的昌盛时期, 科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol∙L-1。
科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol∙L-1。
⑴ 请根据测定原理写出有关反应的离子方程式 ▲ ;
⑵ 计算该样品此时c(O2-) = ▲ ;
⑶ 如用羟胺氧化法测定O2-时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(用KMnO4标准溶液进行滴定)
① 请写出其测定原理的反应方程式 ▲ ;
② 测定所用的主要玻璃仪器为 ▲ ,通过观察 ▲ 的现象可确定测定反应是否进行完全。
(Ⅱ)水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一。检测水中的NO2-可用比色法,其步骤是:
a. 配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
b. 配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平
底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对苯磺酸粉末,实验结果如下表所示:
| 色阶序号 |
1 |
2 |
3 |
4 |
5 |
6 |
| 加入溶液B的体积(mL) |
0 |
2.0 |
4.0 |
6.0 |
8.0 |
10.0 |
| 反应后溶液颜色 |
由无色变为由浅到深的樱桃红色 |
c. 检测:取10mL水样倒入比色管中,加少许对氨基苯磺酸,显色后与标准色阶对比。请填写以下空白:
① 比色法的基本依据是 ▲ ;
② 若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为 ▲ mg/L。
③ 用NaNO2直接配制溶液B的缺点是 ▲ 。
④ 如果水样显色后比6号还深,应采取的措施是 ▲ 。
用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题
(1)请写出该实验的实验步骤
①计算,②称量,③,④冷却,⑤移液,⑥洗涤并移液,⑦,⑧ 摇匀。
(2)所需仪器为:500mL容量瓶、托盘天平、玻璃棒、烧杯,还必需一个仪器,该仪器的名称是:。使用容量瓶前必须进行的操作是。用托盘天平称取氯化钠固体的质量是________g
(3)试分析下列操作对所配溶液的浓度有何影响。(填“偏高”或“偏低”或“无影响”)
①容量瓶没有干燥,有少量的蒸馏水:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度:。
③定容是俯视刻度线:。
(1)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的两个错误是:
___________________________________________________;___________________________________________________。
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为___________g.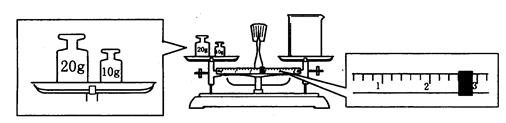
(3)指出下面3个实验中各存在的一个错误:
A__________________________,B__________________________,
C___________________________
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。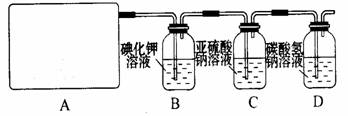
试回答:
(1)该实验中A部分的装置是 (填写装置的序号)。

(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)若D中反应后的溶液具有漂白性,请写出D装置中发生反应的离子方程式 。
(4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:取漂白粉适量,研磨后溶解,配制成漂白液,运用下列实验,检测该漂白液的性质。
①将少量漂白液滴入含有淀粉的KI溶液中,溶液中出现蓝色;
②用pH试纸检测漂白液,试纸边缘为蓝紫色(pH=13),中间部分为白色;
③向漂白液中加入少量稀硫酸,溶液变为黄绿色,产生使湿润的淀粉KI试纸变蓝的气体。
请回答以下问题:
a、实验①表现出该消毒液具有 性;
b、实验②用pH试纸检测消毒液的操作是 _______________________;
c、实验③中涉及反应的离子方程式为 ____________;
某实验小组用浓盐酸和MnO2制取并探究Cl2化学性质,设计装置图如下图所示:
(1)A是氯气发生装置(省略未画),制备Cl2的化学反应离子方程式是, A装置除了酒精灯、圆底烧瓶外还用到的玻璃仪器有。
(2)从C装置出来的气体中含有CO2和HCl,则在C装置中发生的化学反应方程式为:
。
(3)同学们在实验中发现,若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。
①提出合理假设
假设1:H+的浓度不够大;
假设2:;
假设3:_________________________ _。
②设计实验方案,进行实验。在答题卷上写出实验步骤以及预期现象和结论。
限选实验试剂:蒸馏水、浓H2SO4、NaCl固体、MnO2固体、1mol/L稀盐酸、1mol/LAgNO3溶液、淀粉-KI溶液
| 实验步骤 |
预期现象与结论 |
| 步骤1:取少量1mol/L稀盐酸于试管A中,加入少量MnO2, 。 |
|
| 步骤2:取少量1mol/L稀盐酸于试管B中,加入少量MnO2, 。 |
.利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.
(A)(B)(C)
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复使用),请填写对应的序号:
①、②、③、④、⑤、⑥、⑦.
(2)实验中使用了空气,其作用是;若通入空气的速度过快或通入空气的量不足,则所测定Na2CO3的含量(填“偏高”、“偏低”或“准确”).
(3)干燥管Ⅱ的作用是,若缺乏干燥管Ⅱ,其后果是.
(4)若分液漏斗中④的滴液速度过快,将导致实验结果(填“偏高”、“偏低” 和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量分数的数学表达式为。