(1)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的两个错误是:
___________________________________________________;___________________________________________________。
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为___________g.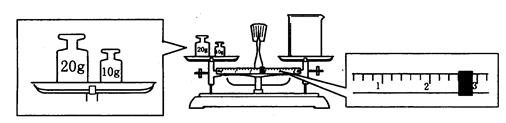
(3)指出下面3个实验中各存在的一个错误:
A__________________________,B__________________________,
C___________________________
(9分)下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题: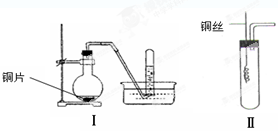
(1)铜与稀硝酸反应的化学方程式______。
(2)学生甲用装置Ⅰ探究铜与稀硝酸反应的气体产物。实验过程在烧瓶中观察到有红棕色气体产生,在试管中收集到无色气体。烧瓶中产生红棕色气体的原因是
(用方程式表示)。
(3)学生乙认为,甲用装置Ⅰ实验,无法说明问题。为了证明并观察到铜与稀硝酸反应的产物为NO,甲设计了如图Ⅱ所示的实验装置,选择下列药品,并按下列实验步骤完成该实验。请你根据他的思路,回答下列问题:
药品:稀硝酸锌粒石灰石固体
步骤:
①检查装置的气密性
②向试管中加入一定量CaCO3固体
③向试管中倒入过量的稀HNO3并迅速盖上带铜丝和导管的橡皮塞
④待反应完全后,将导管插入试管内接近液面
⑤将铜丝插入到溶液中
⑥用注射器的针头穿过橡皮塞并向试管内推入氧气(或空气)
(ⅰ)步骤②目的是;
(ⅱ)推入氧气或空气的目的是;
(ⅲ)分别将等质量的铜片与等体积均过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出,这可能是Cu2+的浓度差异引起的,你同意这种看法吗?(填“同意”或“不同意”),原因是。
某中学化学小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二氧化锰的最佳催化温度均在500℃左右。于是对A和二氧化锰的催化性能进行了定量对照实验。实验时均以收满500mL氧气为准(其他可能影响实验的因素均已忽略)。
请回答:
(1)上述实验中的待测数据应是:______________。
(2)完成此研究后,他们准备发表一篇研究报告,请你替他们拟一个报告的题目:______________________________________________。
100ml0.50mol·L-1盐酸与100mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)烧杯间填满碎纸条的作用是。
(3)实验中若改用110mL0.50mol·L-1盐酸跟100mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会;(填“偏大”“偏小”或“无影响”)。
(5)在量热计中将22.3℃、100ml 1.0mol/L的盐酸与等体积等温度的1.00mol/L的氢氧化钠溶液混合,温度最高升高到29.00℃。已知量热计的热容是46.1J/K,此条件下的NaCl溶液的比热容为4.03J/(g.K),溶液的密度为1.02g/ml,试计算生成每摩NaCl的
反应热(直接写答案)KJ/mol。
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
(1)该实验应选用作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器名称是
(2)下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为mL
(3)滴定操作时,眼睛应注视
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液时,为充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简,需带单位)c(醋酸)=
已知:CH3CH2OH+NaBr+H2SO4(浓)  CH3CH2Br+NaHSO4 +H2O。
CH3CH2Br+NaHSO4 +H2O。
实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下:
①按下图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小火加热,使其充分反应。
试回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体的化学式为
。
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(3)反应结束后,U形管中粗制的溴乙烷呈棕黄色。将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取(填“上层”或“下层”)液体。为了除去其中的杂质,可选择下列试剂中的(填序号)。
| A.Na2SO3溶液 | B.H2O | C.NaOH溶液 | D.CCl4 |
(4)要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行(填操作名称)。
(5)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后(填序号)。
①加热②加入AgNO3溶液③加入稀HNO3酸化④加入NaOH溶液⑤冷却