如图甲所示,某同学将一小块钠放在石棉网上加热,观察到生成的产物除了淡黄色固体外还有一些黑色固体物质,当时他想这种黑色物质应该是钠表面吸附的煤油不完全燃烧产生的碳单质,但在学习了镁与C02的反应后,该同学想:就金属活动性而言,Na比Mg还强,该黑色物质是否是Na与C02反应生成的碳单质。为了验证自己的想法,该同学利用装置乙进行实验。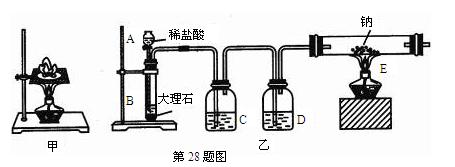
实验步骤如下:①切取一小块金属钠,用滤纸完全吸干煤油,再除去表面的氧化层,放进干燥的E中;
②打开分液漏斗的活塞,使B中的反应进行一段时间后,再点燃E处的酒精灯。
实验现象如下:钠在充满C02气体的玻璃管中剧烈燃烧起来,产生大量的白烟;玻璃管中有黑色物质生成;待玻璃管冷却后,管壁上附着一层白色物质。
请回答下列问题:
(1)C中盛放的试剂是 ,作用是 。D中盛放的试剂是 ,作用是 。
(2)B中的反应进行一段时间后,再点燃E处的酒精灯的目的是 。
(3)该同学将白色物质和黑色物质分别溶于水,发现黑色物质不溶于水,白色物质能溶于水。由此,该同学得出结论,该黑色物质是Na与C02反应生成的碳单质,则其他生成物还应该有 。
(4)请设计一实验方案验证玻璃管内Na与C02反应生成的白色物质的成分,并写出实验步骤、现象和结论 。
(5)若先点燃E处的酒精灯,再打开分液漏斗的活塞,写出此时玻璃管E中可能发生的反应的化学方程式 。
0.5mol NH4Cl的质量是g,含有H原子mol,将此0.5mol NH4Cl与足量消石灰共热反应可制得NH3 L(标准状况下),用法收集产生的NH3,可用靠近集气瓶口,若则氨气已收集满。
实验室为了防止FeCl2溶液变质,通常向该溶液的试剂瓶中加入适量的粉,取适量FeCl2溶液于试管中,滴入适量的NaOH溶液产生色絮状沉淀,继而迅速的变为色,最后变为色的(写化学式)沉淀。
合金的硬度一般比它的各成分金属的,合金的熔点一般比它的各成分金属的,我国使用最早的合金是。
工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)下图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是;NaOH溶液的出口为(填字母);精制饱和食盐水的进口为(填字母);干燥塔中应使用的液体是。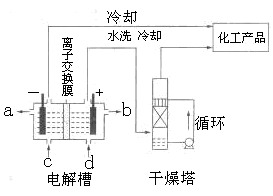
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
① SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为。
② SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为 ______kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气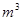 (标准状况)。
(标准状况)。
(1)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。)
(2)发射飞船时肼(N2H4)与NO2作推力能源,两者反应产生氮气和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g)△H="+67.7" kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol
则肼与二氧化氮反应的热化学方程式为:
(3)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2+O2=2H2O。酸式氢氧燃料电池的电解质溶液是强酸溶液,其负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为;碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2+2H2O+4e一=4OH一,则其负极反应式为