A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置 ;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学式表示): ;写出C与A形成的18e-化合物的电子式 ;
(3)用电子式表示A2C的形成过程:
(4)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:
____________________________________________________;
写出题中生成M的化学方程式
(5)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则负极上的电极反应式为__________________________,若标准状况下,正极消耗3.36L气体,则通过外电路的电子是 个。
某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)______25℃,理由是_________________________________________________,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合溶液为中性,则a:b=_________;
(2)若所得混合溶液pH=2,则a:b=__________。
下图表示的是N2 + 3H2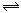 2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率)
2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率) 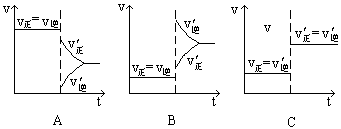
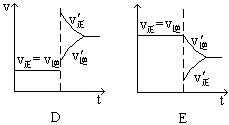
(1)表示减少H2的量而建立新平衡的是。
(2)表示压缩气体, 体积减小而建立新平衡的是。
(3)表示降低温度而建立新平衡的是。
(4)表示升高温度而建立新平衡的是。
(5)表示加入催化剂后而建立新平衡的是。
已知电子工业上常用FeCl3溶液来溶解电路板中的铜。某一反应体系有反应物和生成物共三种物质:FeCl3、FeCl2、Fe。完成下列问题:
(1)该反应中的还原产物的化学式是,氧化产物的化学式是。
(2)该反应中,发生还原反应的过程是(填化学式)→。
(3)该反应的离子方程式为:。
(4)标出该反应电子转移的方向和数目
(5)如反应转移了0.3mol电子,则(填“溶解”或“生成”)的铁的质量为。
有A、B、C、D四种盐,组成它们的阳离子有:Ba2+、Ag+、Na+、Cu2+中,阴离子有:NO3-、Cl-、SO42-、CO32-。某同学设计实验对它们进行鉴别:
⑴ 把四种盐分别溶解于盛有蒸馏水的四支试管中,均得到澄清溶液。通过观察及分析,该同学得出如下结论:
①可以确定的是A,则A为:(填化学式,下同);
②另三盐分别是:、 、,但不知道分别对应哪种物质。
⑵ 再向未确定的三支试管中分别加入盐酸,则B盐溶液有沉淀产生,C盐溶液有无色无味气体产生。该同学确定另三种盐的化学式分别为:
B_____________,C_____________,D_______________。
⑶ 请你帮该同学完成下列反应的离子方程式:
B+盐酸:
C+盐酸:
A与D混合:
验需要0.1mol/LNaOH溶液450mL,根据溶液配制中情况回答下列问题:
⑴ 实验中不需要的仪器有:
A.托盘天平 B. 烧杯 C. 500 mL容量瓶 D.玻璃棒 E.滴管 F.铁架台 G.烧瓶 H.酒精灯
⑵ 根据计算得知,所需NaOH的质量为g
⑶ 下列操作对所配浓度有何影响(填写字母)
偏大的有;偏小的有;无影响的有。
A、称量时用了生锈的砝码;
B、将NaOH放在纸张上称量;
C、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D、往容量瓶转移时,有少量液体溅出
E、未洗涤溶解NaOH的烧杯
F、定容时仰视刻度线
G、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,不再加水。
H、容量瓶底部未干燥即用来配制溶液