现有苯、甲苯、乙烯、乙醇、1-氯丁烷、苯酚、软脂酸甘油酯、油酸、淀粉,其中:(1)显酸性的是________ 。(2)常温下能和溴水反应的是________ 。(3)能和金属钠反应放出氢气的是_______________ 。(4)能和FeCl3溶液反应产生紫色的物质的是________ 。
下列4组物质均有一种物质的类别与其它3种不同,请找出并填在下面空格。
A.CaO、Na2O、CO2、CuO B.C、Na、Mg、Al
C.Na2CO3、FeSO4、Cu(NO3)2、KOH D.H3PO4、H2O、H2SO4、HNO3
以上四组物质中与其他三个不同的物质依次是(填化学式)
A;B;C;D。
在AlCl3溶液中,逐滴滴入NaOH溶液,刚开始可以观察到,写出有关的化学方程式,继续往溶液中滴入NaOH溶液,可以观察到,写出有关的离子方程式。
高分子材料M在光聚合物和金属涂料方面有重要用途,M的结构简式为: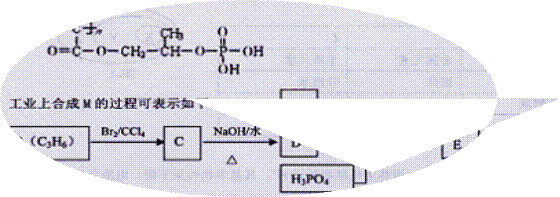
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、0原子个数比为3:1。它与Na或Na2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是 。
(2)下列说法正确的是 (填序号字母)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D在水中的溶解性很大,遇新制Cu(OH)2悬浊液,溶液呈绛蓝色
d.E—M的反应是缩聚反应
(3)写出A+D+H3PO4--E反应的化学方程式: ,该反应类型是 。
(4)F是A的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。存在下列转化关系: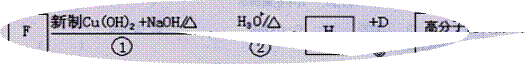
写出F、N的结构简式为:F: N:
写出反应①的化学方程式____
污水处理 分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:
分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:
Cu2++2 H2Dz Cu(HDz)2+2H+,
Cu(HDz)2+2H+,
再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式:。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是。
下图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。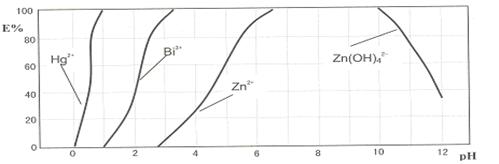
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=
(3)当调节pH=2时,铋(Bi)的存在形式有:,其物质的量之比为
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
含氮废水进入水体后而对环境造成的污染越来越严重,对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。
⑴环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—。又有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
写出镁和含NO3-的废水反应的离子方程式____________________。
⑵水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染程度的标志之一。检测水中的NO2-可用目视比色法(比较溶液颜色深浅度以测定所含有色物质浓度的方法),检测步骤如下:
步骤一:配制标准溶液:称取0.69gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
步骤二:配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具有塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.30g)氨基苯磺酸粉末,实验结果如下表所示。
| 色阶序号 |
1 |
2 |
3 |
4 |
5 |
6 |
| 加入溶液B的体积/mL |
0.0 |
2.0 |
4.0 |
6.0 |
8.0 |
10.0 |
| 反应后溶液颜色 |
由无色变为由浅到深的樱桃红色 |
步骤三:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
①利用步骤三在野外检测水样污染程度的优点是。
②步骤二中设计色阶序号1的作用是。
③如果水样显色后比6号还深,应采取的措施是 。
。
⑶现有含NH3为3.4mg·L—1的废水150m3(密度为1g·cm- 3),可采用如下方法进行处理:将甲醇加入含氨的废水中,在一种微生物作用下发生反应:
3),可采用如下方法进行处理:将甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2 + NH3=== NO3- + H+ + H2O 6NO3-+ 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若用此方法处理,假设每步的转化率为100%,需要甲醇g。