化学科学在药物的开发、合成和使用中起着至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式: 。
(2)自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:_________________ ___。
(3)检验Fe3+常用的试剂除碱外,还可以用 (填化学式),现象是 。
下表是元素周期表的一部分,根据表中10种元素,用元素符号或化学式填空。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
|||
| 4 |
⑨ |
⑧ |
⑩ |
(1)①~⑩元素中,金属性最强的是;化学性质最不活泼的是。
(2)①~⑩元素中,最高价氧化物水化物呈两性的是,该化合物与NaOH溶液反应的离子方程式为;
(3)①~⑩元素中,最高价氧化物水化物酸性最强的是,碱性最强的是;
(4)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是;
用50mL 0.50 mol•L-1盐酸与50mL 0.55 mol•L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: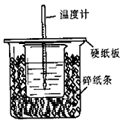
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热△H绝对值。(填偏大、偏小、无影响)
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:A;B;C 。
(2)画出D的原子结构示意图_____;B在周期表的位置为第周期族。
(3)化合物A2D的电子式是_______________。
(4)B、C、D的气态氢化物稳定性由强到弱的顺序是_____________。(用化学式表示)
(5)B的最高价氧化物的结构式。
(6)写出单质E与A2D反应的离子方程式。
下图为周期表的一小部分,A、B、C、D、E、F的位置关系如图所示。其中B元素的最高价是负价绝对值的3倍,它的最高价氧化物中含氧60%,回答下列问题:
| F |
A |
|||
| D |
B |
E |
||
| C |
||||
(1)A在周期表中的位置为;E的离子结构示意图为;化合物DE3的电子式_______。
(2)F元素氢化物的空间构型为_______。
(3)D、B、E元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序。(用化学式表示)
(4)B、C、E的气态氢化物稳定性由强到弱的顺序是________。(用化学式表示)
(5)B的单质与其最高价氧化物的水化物的浓溶液共热能发生反应,化学方程式为
。
(6)F2H4和FO2是一种双组分火箭推进剂。两种物质混合发生反应生成F2和H2O(g),已知8g F2H4气体在上述反应中放出142kJ热量,其热化学方程式为。
(7)请在答题卷相应位置画出金属与非金属元素的分界线。
(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6 kJ的热量,试写出对应的热化学方程式。标准状况下11.2L氢气在氯气中充分燃烧放出的热量是kJ。
(2)A(g)+B(g) C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。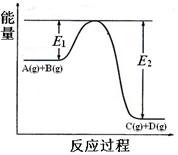
①反应物A(g)和B(g)具有的总能量(填大于、小于、等于)生成物C(g)和D(g)具有的总能量。
②该反应是_______反应(填吸热、放热),△H=(用E1和E2表示)。
③稳定性:反应物生成物(填大于、小于、等于)。