A、B、C、D、E五种短周期元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:A ;B ;C 。
(2)画出D的原子结构示意图_____;B在周期表的位置为第 周期 族。
(3)化合物A2D的电子式是_______________。
(4)B、C、D的气态氢化物稳定性由强到弱的顺序是_____________。(用化学式表示)
(5)B的最高价氧化物的结构式 。
(6)写出单质E与A2D反应的离子方程式 。
恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g)  C(g)
C(g)
(1)若开始时放入1 mol A+1 mol B,到达平衡后,生成a mol C,这时A的物质的量为________ mol.
(2)若开始时放入3 mol A和3 mol B,到达平衡后,生成C的物质的量为________ mol.
(3)若开始时放入x mol A,2 mol B和1 mol C,到达平衡后,A和C的物质的量分别为y mol和3a mol,则x=________mol,y=________mol.平衡时,B的物质的量________(选填一个编号).
(甲)大于2 mol (乙)等于2 mol (丙)小于2 mol (丁)可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是________.
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
_______________________________________________________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
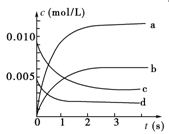
(1)写出该反应的平衡常数表达式:K=________。已知:K300 ℃>K350 ℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向逆反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH =" -92.2" kJ·mol-1。
2NH3(g);ΔH =" -92.2" kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2﹑t4﹑t5﹑t7时刻所对应的实验条件改变分别是
t2t4t5t7。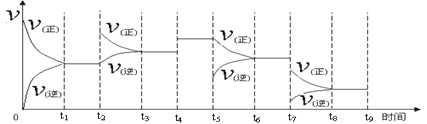
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为。
(2)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入1mol及2mol碘化氢待反应:2HI(g) H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)Ac(I2)B;平衡时HI的分解率αAαB;平衡时H2在混合气体中的体积分数AB (填写“>”“<”“=”)
H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)Ac(I2)B;平衡时HI的分解率αAαB;平衡时H2在混合气体中的体积分数AB (填写“>”“<”“=”)
⑴ 现有0.1mol·l-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作。
⑵ 欲使0.1mol-1Na2CO3溶液中c(Na+)=2 c(CO32-),应采取的措施是()
A.加少量盐酸 B.加适量的KOH C.加适量的水 D.加适量的NaOH
⑶ 为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是()
A.甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B.乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C.丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D.丁同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
⑷ 为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。