为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对 标准。表1有(A)至(I)共九种气体在大
标准。表1有(A)至(I)共九种气体在大 气中的体积百分比及其温室效应指
气中的体积百分比及其温室效应指 数。
数。
结合表中列出的九种气体,试参与回答下列各题: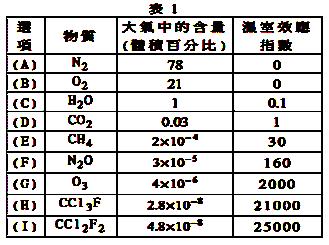
(1)下列由极性键形成的极性分子是 。
A.N2 B.O2 C.H2O D .CO2 E.CH4
.CO2 E.CH4
(2)下列说法不正确的是 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B. C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的 。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高 压下形成的晶体
压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某红紫色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为 。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ Co(NH3)5(H2O)]Cl3
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ CoCl(NH3)5]Cl2·H2O。
(6)题(5)中钴离子在基态时核外电子排布式为: 。
(7分)W、X、Y、Z四种短周期元素的原子序数依次增大 。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在
。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在 同周期中最小。
同周期中最小。
(1)写出下列元素的元素名 称:W,X,Y
称:W,X,Y ,Z。
,Z。
(2)与XY分子互为等电子体是。
(3)XY2与ZYW溶液反应 时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是(写化学式)。
时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是(写化学式)。
(4)W2、W2Y、XY2三种分子中,以极性键结合的 非极性分子是(写化
非极性分子是(写化 学式)。
学式)。
(1)在同一个原子中,离核越近、n越小的能层中的电子能量越。理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和。现代物质结构理论证实,原子 的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做原子。
的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做原子。
(2)写出下列基态原子的简化电子排布式:
①14Si ;②26Fe 。
(3)按所示格式填写下表中的空格:
| 原子序数 |
原子的价电子排布式 |
周期 |
族 |
| 17 |
第三 |
||
| 3d54s1 |
ⅥB |
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,计算说明N2中的
键更稳定(填“σ”或“π”)。
(5)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是,配离子 [Cu(NH3)4]2+的配体是。
(6)根据价层电子对互斥理论判断:
①NH3分子中,中心原子上的σ键电子对数为,孤电子对数为,价层电子对数为,中心原子的杂化方式为杂化,VSEPR构型为,分子的立体构型为 。
。
②BF3分子中,中心原子的杂化方式为 杂化,分子的立体构型为。
杂化,分子的立体构型为。
X、Y、Z、W、V为前四周期常见的五种元素,其中四种为短周期元素。X原子核外电子数等于其电子层数;常温常压下,Y单质固体难溶于水而易溶于CS2;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。
请回答下列问题:
(1)写出实验室通过加热制备z单质的离子方程式;
(2)W的两种常见氧化物中阳离子和阴离子个数比为2:1的是(写化学式);
(3)写出X、Y、W三种元素组成的化合物的水溶液与Z单质反应的离子方程式(可不配平);
(4)检验V的最高价简单离子常用的试剂是;
(5)将12gY单质完全燃烧的产物通入100mL 1.2mol.L-1的氢氧化钠溶液中,所得溶液中含有的主要离子分别是。
置换反应的通式可表示为(转化中涉及的均为中学化学的常见物质):
请回答下列问题:
(1)若单质甲与化合物A发生的反应常用于野外焊接钢轨,则该反应的化学方程式为;
(2)若甲、乙分别是同主族的两种非金属固体单质,则化合物A的一种主要用途是;
(3)若甲、乙分别是同主族短周期元素的两种单质,化合物B是一种强碱,则反应的离子方程式为;
(4)若组成单质乙的元素的最外层电子数是次外层电子数的2倍,金属单质甲能在化合物A中燃烧,则该反应中氧化剂与还原剂的物质的量之比为;若反应中生成2.4g单质乙,则消耗的化合物A在标准状况下的体积为。
有一瓶澄清溶液,可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-中的一种或几种。取该溶液进行以下实验:
①用pH试纸检验,表明溶液呈强酸性;
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色;
③另取部分溶液,向其中逐滴加入NaOH溶液,使溶液从酸性变为碱牲,在滴加过程中先生成白色沉淀后完全溶解;取部分碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝。
④另取部分③中的碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
根据以上实验事实回答下列问题:
(1)该溶液中肯定存在的离子是,肯定不存在的离子是;
(2)步骤③加入NaOH溶液过程中先生成白色沉淀后完全溶解的离子方程式为;