过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。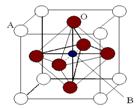
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形 成氢键
成氢键
Ⅱ、2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑴用A、B、O表示这类特殊晶体的化学式: 。
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。(用含x的代数式表示)
、⑶Mn的外围电子轨道表示式为: 。
⑷下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如右图:
D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属,且C的合金用量最大。三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A________、H__________、乙_______、C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是;
(2)写出下列反应的化学方程式:
反应①_____________________________________;
反应②_____________________________________。
(3)检验溶液G中金属阳离子的常用方法是。
(10分)在新制氯水中存在的多种粒子中:(用化学式或离子符号填空)
(1)使氯水呈黄绿色的是。
(2)能使硝酸银溶液产生白色沉淀的是。
(3)能使紫色石蕊试液显红色的是。
(4)能使湿润的红布条褪色的是。
(5)能使无水硫酸铜变蓝的是。
选考(化学-有机化学基础)阿司匹林能迅速解热、镇痛。长效缓释阿司匹林可在体内逐步水解而疗效更佳。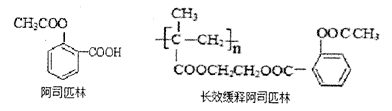
用丙酮为主要原料合成长效缓释阿司匹林的流程如下图。
(1)B含有的官能团的名称是,反应①的反应类型为。
(2)下列有关阿司匹林的叙述正确的是(填选项编号)。
| A.属于芳香烃 |
| B.分子式为C9H10O4 |
| C.能与NaHCO3溶液反应生成无色气体 |
| D.在酸性条件下水解生成的产物之一可使FeCl3溶液显紫色 |
(3)D的结构简式。
(4)写出B→C反应的化学方程式。
(5)有机物A是阿司匹林的同分异构体,具有如下特征:
①苯环含有对二取代结构;
②能发生银镜反应;
③能发生水解反应且产物中的2种为同系物或同种物质。
写出A的结构简式(只写一种)。
选考(化学-物质结构与性质)
(1)基态铬原子的价电子排布式为。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为:
K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
上述反应式中非金属元素电负性由大到小的顺序是(用元素符号表示)。
(3)随着人们生活质量的提高,室内的环境安全和食品安全越来越为人们所关注。甲醛(HCHO)是室内主要空气污染物之一(其沸点是–19.5 ℃),甲醇(CH3OH)是“假酒”中的主要有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是。
(4)双氰胺结构简式如图所示。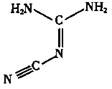
①双氰胺分子中σ键和π键数目之比为。
②双氰胺分子碳原子的杂化类型为。
(5)镍元素能形成多种配合物,配离子[Ni(CN)4]2+中不含有的作用力是(填选项编号)。
| A.离子键 |
| B.配位键 |
C.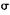 键 键 |
D. 键 键 |
E.氢键
(6)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图所示,则其化学式为。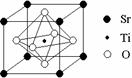
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示。回答下列问题:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| PH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
(1)孔雀石研磨的目的是。
(2)孔雀石的主要成分与足量稀硫酸反应的化学方程式为。
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用(填选项序号)。
A.酸性KMnO4溶液B.双氧水C.浓硝酸D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离。则pH的范围为。
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是(填代号及对应物质的化学式)。
(6)由溶液C获得CuCl2·3H2O,需要经过、、过滤等操作。
(7)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+反应平衡常数。
Cu(OH)2+2H+反应平衡常数。