孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示。回答下列问题:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| PH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
(1)孔雀石研磨的目的是 。
(2)孔雀石的主要成分与足量稀硫酸反应的化学方程式为 。
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用 (填选项序号)。
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离。则pH的范围为 。
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是 (填代号及对应物质的化学式)。
(6)由溶液C获得CuCl2·3H2O,需要经过 、 、过滤等操作。
(7)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+反应平衡常数 。
Cu(OH)2+2H+反应平衡常数 。
工业上对海水资源综合开发利用的部分工艺流程如下图所示。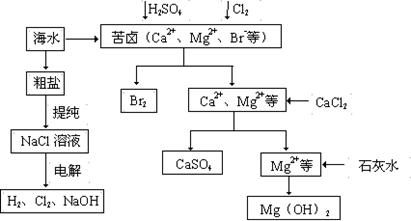
⑴ 粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性。请写出加入Na2CO3溶液后相关化学反应的离子方程式:
、。
⑵ 从海水中提取溴,主要反应为2Br- + Cl2 = Br2 + 2Cl-,下列说法错误的是(填序号)。
| A.溴离子具有氧化性 | B.氯气是还原剂 |
| C.该反应属于复分解反应 | D.Br2是氧化产物 |
⑶ 本工艺流程中先后制得Br2、CaSO4、Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?
(填“能”或“否”),原因是。
(12分)(1)5molCO2的质量是_________;在标准状况下所占的体积约为_________;所含的分子数目约为________________;所含氧原子的数目约为_________________。
(2)12.4gNa2X中含有0.4molNa+,则Na2X的摩尔质量是________,X的相对原子质量是________,该物质的化学式为________。
(3)有下列7种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3、H2O组成一个氧 化还原反应,请回答下列问题:
化还原反应,请回答下列问题:
①将余下几种物质分别填入下面对 应的横线上,组成一个未配平的化学方程式:
应的横线上,组成一个未配平的化学方程式:
________+Na2SO3+________→ Na2SO4+________+________+H2O
②反应物中发生氧化反应的物质是_________(填化学式),被还原的元素是_______。
(4分)现有以下物质:
①NaCl溶液 ②液态SO3 ③液态的醋酸 ④铜` ⑤Ba(OH)2固体
⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔化KNO3 ⑨CO2
请回答下列问题(用序号):
(1)其中属于电解质的是:________________。(2)能够导电的物质是: _______________。
实验室制取下列气体时,应选用下列哪种酸:(填入相应的字母。)
| A.浓盐酸 | B.稀盐酸 | C.稀硫酸 | D.浓硫酸 |
⑴用大理石和制CO2 ;⑵用MnO2和制Cl2;
⑶用锌粒和制H2 ;⑷用食盐和制HCl。
漂白粉是一种很好的消毒剂和漂白剂。制取漂白粉是用___________和____________反应,请写出其化学方程式__________________________________________。漂白粉的有效成分是__________。漂白粉在空气中很容易变质,请写出漂白粉在空气中变质的机理(写反应方程式)_____________________________________________________ 。