下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。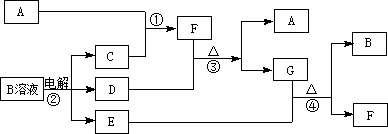
(1)写出化学式A ,D ,G ,
写出电子式F ;
(2)鉴定G中阳离子的实验方法和现象:_________________________________ ;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式D+E ③ 。
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目 。
工业上生产硫酸 时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%
时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% ,O2 11%,N2 82%);
,O2 11%,N2 82%);
 |
0.1 |
0.5 |
1 |
10 |
| 400 |
99.2 |
99.6 |
99.7 |
99.9 |
| 500 |
93.5 |
96.9 |
97.8 |
99.3 |
| 600 |
73.7 |
85.8 |
89.5 |
96.4 |
(1)利用 表中数据推断SO2的氧化是(填“吸热”或“放热”)反应;
表中数据推断SO2的氧化是(填“吸热”或“放热”)反应;
(2)在400~500℃时,SO2的催化氧化采用(填“常压”或“高压”);
(3)选择适宜的催化剂,是否可以提高SO2的转化率?(填“是”或“否”),是否可以增大该反应所放出的热量?(填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
(1)电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是。
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中会生成白色固体,发生的总反应化学方程式为
。
该白色固体露置在空气中,可观察到的现象是
。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH )2,恰好恢复电解前的浓度和pH,则电解过程中电子转移的物质的量为mol。
)2,恰好恢复电解前的浓度和pH,则电解过程中电子转移的物质的量为mol。
(2)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。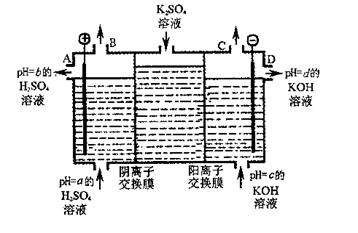
①该电解槽的阳极反应式为,通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为;
③电解一段时间后,B口与C口产生气体的质量比为。
A、B、C、D、E均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
| 阳离子 |
Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 |
OH- Cl- CO32- SO42- HCO32- HCO32- |
分别取它们的水溶液进行实验,结果如下:
①A溶液分别与其他四种反应,均有沉淀;
②B溶液分别与其他四种溶液反应,也有沉淀;只有当B溶液加入到D溶液中时,先有沉 淀,继续加入B溶液时,沉淀会消失。
淀,继续加入B溶液时,沉淀会消失。
据此推断它们是:A;B;C;D;E。
(1)1.00L1.00mol/LH2SO4溶液与2.00L1.00mol/LNaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为。
(2)由金红石(TiO2)制取单质Ti,涉及到的步骤为: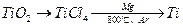
已知:①C(s) + O2(g) = CO2(g);ΔH=-393.5kJ/mol
②2CO(g) + O2(g) = 2CO2(g);ΔH=-566kJ/mol
③TiO2(s) + 2Cl2(g) = TiCl4(s)+O2(g);ΔH=+141kJ/mol
2Cl2(g) = TiCl4(s)+O2(g);ΔH=+141kJ/mol
则a.碳在氧气中不完全燃烧生成CO的热化学方程式为
。
b.TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(s) + 2CO(g)的ΔH=________________。
物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节)
(1)两种互不相溶的液体的分离。
(2)固体和液体的分离。
(3)含固体溶质的溶液中除去部分溶剂。
(4)胶体中分离出可溶电解质。
(5)几种沸点相差较大的互溶液体的分离。