有A、B、C、D、E五种原子序数均小于30且依次增大的元素。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)C、D形成的化合物化学式为______,A的单质分子中π键的个数为________。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是_____________。
(3)A、B、C三种元素的第一电离能由大到小的顺序为______(用元素符号表示)。
(4)向E单质与适量浓硫酸反应后的溶液中逐滴加入A的最简单气态氢化物的水溶液,看到的现象是____________。
(5)A的最简单氢化物分子易与H+结合生成空间正四面体形的阳离子,而A与C形成的分子却难与H+结合,原因是_____________。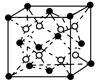
(6)C和D形成的化合物的晶胞结构如上图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则晶胞边长a=________cm(用ρ、NA的计算式表示) 。
合成氨的流程示意图如下: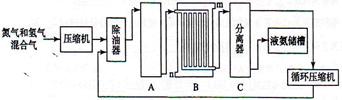
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 , ;
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是 ,其中发生的化学反应方程式为 ;
(3)设备B的名称是 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因是 ;
(4)设备C的作用是 ;
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过以下反应来实现:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中的c(H2O):c(CO)不低于 。
(2014届河北省唐山市高三4月第二次模拟理综化学试卷)
某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)乙同学认为甲同学的结论是错误的,他的理由是 (用化学方程式表示),所以他认为应该检验 (填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。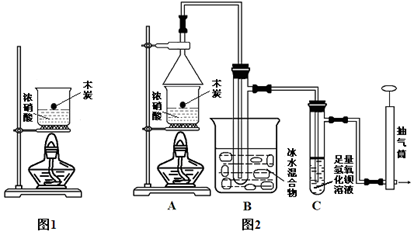
(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号) 。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸;④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用 。
(4)C装置中出现的现象是 ,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式 。
(2014届湖南省益阳市高三下学期模拟考试理综化学试卷)
铜是人类最早生产和使用的金属之一,在化学反应中铜元素可表现为0、+1、+2价。
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 。
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
Ⅱ.学习小组对无水硫酸铜分解的产物进行实验探究。
【提出问题】碳酸钙受热分解生成CaO和CO2,那么无水硫酸铜受热分解也只生成CuO和SO3吗?
【设计实验】按如图装置进行试验。
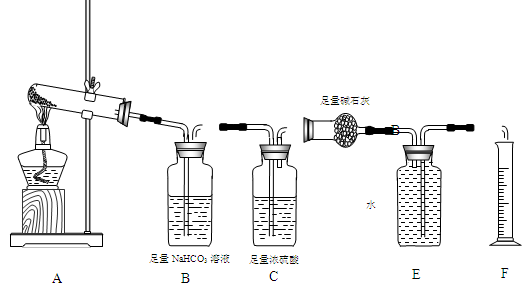
【实验过程】
a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为CuO。
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g。
(3)装置C的作用 。
(4)根据装置E、F中现象,推测还有气体 (填分子式)生成;实验生成的SO3为 mol。(5)装置A中反应的化学方程式为 。
【实验结论】无水硫酸铜受热分解不仅仅生成CuO和SO3。
【反思与评价】
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素是 (任写2点)。
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。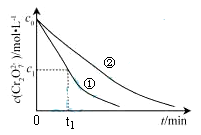
| 实验编号 |
初始pH |
废水样品体积mL |
草酸溶液体积mL |
蒸馏水体积mL |
| ① |
4 |
60 |
10 |
30 |
| ② |
5 |
60 |
10 |
30 |
| ③ |
5 |
60 |
测得实验①和②溶液中的Cr2O 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式)。
(3)实验①和②的结果表明 ;实验①中0~t1时间段反应速率v(Cr3+)= mol·L-1·min-1
(用代数式表示)。
(4)该课题组队铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二: ;
假设三: ;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、Al2Fe(SO4)4·24H2O、Al2(SO4)3等,溶液中Cr2O 的浓度可用仪器测定。)
的浓度可用仪器测定。)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3="==" FeCO3↓+Na2SO4FeCO3+C6H8O7="==" FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Al3+ |
3. 0 |
5. 0 |
| Fe2+ |
5. 8 |
8. 8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4溶液, ,得到FeSO4·7H2O 晶体。