W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X的最高价氧化物对应的水化物可以反应生成某复杂化合物,该离子方程式为___________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为_______________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为___________。
(4)比较Y、Z气态氢化物的稳定性:__________(用化学式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是_______________。
在一次兴趣小组活动中,一小组利用物质间的互变,设计成一平面“魔方”如图所示。已知: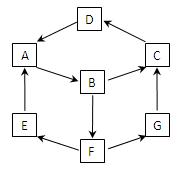
①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体;B与硝酸银溶液反
应生成不溶于稀硝酸的白色沉淀;B也能将一种能形成酸
雨的氧化物氧化为F,F是一种含氧酸,且F的稀溶液
能与A反应生成E和G。
| 物质 |
纯A(单质) |
B(溶液) |
D(固体) |
G(溶液) |
| 颜色 |
银白色 |
黄色 |
红棕色 |
浅绿色 |
③几种物质的部分物理性质:
依据以上信息填空:
(1)G生成C的过程中所出现的现象为;
(2)写出下列反应的化学方程式:
A→B :;
(3)写出下列反应的离子方程式:
B→F:;
酸性条件下,G与次氯酸溶液反应:;
(4)使一定质量的Zn与100mL18.5 mol·L-1酸F的浓溶液充分反应,Zn完全溶解,同时生成标准状况下的气体A 33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol·L-1,则气体A的成份及体积比为。
现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体。回答下列问题:
(1)A分别与B、C形成的最简单化合物中,稳定性>(用分子式表示),其中A与B形成的最简单化合物分子的空间构型为;
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为。
(3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1∶1,则丙中含有的化学键类型是;
(4)B元素的最高价氧化物对应的水化物与其氢化物反应生成的盐的水溶液呈性(填“酸”、“碱”或“中”),用离子方程式解释原因;
(5)写出实验室制取单质E的离子方程式是。
对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则关于X、Y、Z、W四种物质的聚集状态说法正确的是()
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则关于X、Y、Z、W四种物质的聚集状态说法正确的是()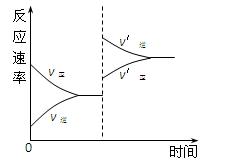
| A.X、Y均为气体,Z、W中有一种为气体 |
| B.Z、W中有一种是气体,X、Y皆非气体 |
| C.X、Y、Z、W皆非气体 |
| D.Z、W均为气体,X、Y中有一种是气体 |
由铝和某些金属氧化物组成的混合物在化学上称为铝热剂,该混合物在高温条件下能发生置换反应。为确定某铝热剂样品(铝和氧化铁)的组成,分别进行下列实验:
(1)若取10.7 g该样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为a L。反应的化学方程式是,样品中铝的质量分数是(用含a的表达式表示)。
(2)若取同质量的样品,在高温下使其恰好反应,则a =L;该反应的化学方程式是。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为b L,该气体与(1)中所得气体的体积比a∶b =_______。
已知A、B、C均为常见单质,其中A是金属,B、C是非金属,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。
请回答下列问题:
(1)若常温下,B、C均为气体,D为黑色磁性固体,则C的化学式为, A和E反应生成D的化学方程式为。
(2)若常温下,B为气体,C为黑色固体粉末,则金属A的原子结构示意图为, A和E在一定条件下反应生成D的化学方程式为。