已知:E为常见金属单质,C、D、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,它们有如下框图关系:
(1)反应①阳极的电极反应式 。
(2)反应③的化学方程式 ,
(3)反应④的离子方程式为 。
(4)K是一种难溶于水的固体,K受热分解可生成H。实现由G溶液到K的转化时可以加入的试剂是(填写选项字母)
A.NaOH溶液 B.氨水 C.Na2CO3溶液 D.NaHCO3溶液
(5)将G的饱和溶液加入到沸水中,继续加热可得红褐色液体,写出反应的离子方程式:
该液体接通直流电后___ __极附近颜色加深,这种过程叫做____ _。
(6)若E中含有合金元素,会导致G不纯。测定G的质量分数通常可用碘量法测定:称取mg无水G样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。(杂质不参与反应) 则样品中G的质量分数为: 。
则样品中G的质量分数为: 。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为_________________________。
⑵ 检验TiO2·x H2O中Cl-是否被除净的方法是_________________________。
⑶ 下列可用于测定TiO2粒子大小的方法是____________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
⑷ 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是______________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_______(填字母代号)。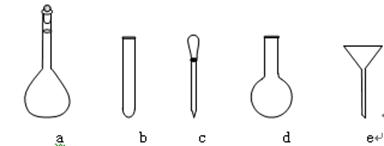
⑸ 滴定终点的现象是__________________________________________。
⑹ 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c m ol·-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_______________
ol·-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_______________ ____。
____。
⑺ 判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果____。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是。
(3)把KI换 成KBr,则CCl4层变为______色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
成KBr,则CCl4层变为______色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
(4)加碘盐中含碘量为25.4mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若将Kl与Cl2反应制KIO3,至少需要消耗Cl2L(标准状况,保留2位小数)
28.(6分,每空2分)已知丙烯与氯化氢的反应原理如下:
主反应:CH2=CHCH3 + HCl → CH3CHClCH3(主要产物);
副反应:CH2=CHCH3 + HCl → CH2ClCH2CH3(副产物) A
A
A;B;C;
(6分,每空1分)已知乙烯发生如下变化:
(1)分别写出B的名称和有机物C 的名称
(2)写出反应①的化学方程式该反应的类型是
(3)写出反应②的化学方程式 该反应的类型是
该反应的类型是
(3分,每空1分)人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为 C6H6 的结构 有多种,其中的两种为
有多种,其中的两种为
1 mol C6H6 与H2加成时:Ⅰ需______mol,而Ⅱ需 _______mol。
(2)今发现 C6H6还可能有另一种如上图立体结构:该结构的二氯代物有_______种。