① 0.4mol NaCl的质量为 g,64g氧气的含氧原子数目为 。
②在标准状况下,44.8L NH3的物质的量为 ,与 克H2S的物质的量相等。
③1.5mol SO2与 g SO3含有相同质量的氧元素。等质量的CO与CO2含氧元素质量比为 。
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B元素的名称为___________;B在周期表中的位置是第___________周期第___________族。
(2)C的元素符号为______________,C的最高价氧化物的化学式为__________________。
(3)D的最高价氧化物对应的水化物的化学式为______________。
已知0.1 mol/L的NaHSO4溶液中H+的物质的量浓度为0.1mo1/L,请下列问题:
(1)写出NaHSO4在水溶液中电离的方程式 。
(2)NaHSO4属于(填“酸”“碱”或“盐”) 。
(3)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为2:1混合,则反应的离子方程式是 。
(4)若将NaHSO4溶液逐滴滴入Fe(OH)3胶体溶液可观察到的现象是 。
工业电解饱和食盐水模拟装置的结构如图所示: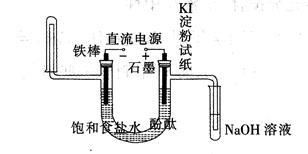
(1)写出电解饱和食盐水的化学方程式 ,该工业称为 工业
(2)实际生产中使用的盐往往含有一些杂质,在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |
(3)在该装置中写出装NaOH溶液试管中所发生的化学反应方程式(并用双线桥表示电子的转移的方向和数目) 。
铁、铝在生产生活中有广泛的应用。完成下列填空:
(1)铝用作电线是利用了铝的 性;铁用作炊具是利用了铁的 性。
(2)常温下由于浓硫酸能使铁 ,因此浓硫酸可用铁槽车运输。
(3)氢氧化铝既能跟盐酸反应又能跟氢氧化钠溶液反应,由此可知氢氧化铝是 物质。氢氧化铝和盐酸反应的离子方程式为 。
完成下列各题
(1)工业上以氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是__(填“CaCl2”或“Ca(ClO)2”)。
(2)某些合成染发剂含有对苯二胺( ),有一定的致癌作用。对苯二胺属
),有一定的致癌作用。对苯二胺属
于 (填“有机物”或“无机物” )。