碳、氢、氧元素的质量比为6∶1∶8的有机物A、B、C、,它们都能发生银镜反应,但都不能发生水解反应。B1、B2是B的同分异构体。又知:
A在常温下为气体,A+C6H5OH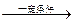 Z(高分子化合物)
Z(高分子化合物)
B1易凝为冰状晶体:B1+Na2CO3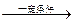 X+CO2+H2O;X+NaOH
X+CO2+H2O;X+NaOH 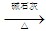 Y(最简单的烃)
Y(最简单的烃)
B2为无色液体,也能发生银镜反应。1 mol C完全燃烧需要3 mol氧气。
−CH(OH)2 或 −C(OH)2− 不稳定,易脱水形成−CH=O或 −CO−。试回答:
(1)A→Z的反应类型
(2)A、B的结构简式:A 、B ;
(3)写出B2与氢氧化钠反应的化学方程式: ;
(4)C的结构简式 ,与C互为同分异构体 ,且属于乙酸酯类化合物
,且属于乙酸酯类化合物
的结构简式 , 。
(15分)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分产物省略)。请按要求回答下列问题:
(1) 若A是氯碱工业的一种重要产品,通常状况下D是一种非极性气体分子,则D的结构式为,A与D以物质的量3:2反应后的溶液中离子浓度的大小顺序为:
(2) 若D为某金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为;将B的溶液加热蒸干再灼烧,所得固体物质的化学式为。
(3) 若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式为;符合此条件的D物质可能是(填序号)
A.H2SO4 B.CH3COOH C. NaOH D.NH3·H2O E.BaCl2
【有机化学基础】
有机物A-F存在如下图转变关系,元素分析得知,A分子内含一个氧原子,氢的质量分数为7. 41%,其相对分子质量为108;A与FeCl3不发生显色反应,A和乙酸反应可以合成一种有茉莉花香的无色油状液体G,G的纯品用于配制花香香精和皂用香精,G和E互为同分异构体,均为芳香族化合物;E的苯环上只有一个取代基且该取代基碳链上无支链.
请回答下列问题:
(1)写出化合物A的分子式; D的结构简式
(2)指出①、③两步的反应类型:①;③
(3)写出反应②的化学方程式:
(4)写出A的同分异构体(不包括A):
【物质结构与性质】
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2 np2,B元素原子的最外层鬼子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:
(1)当n=2时,AB2属于分子(填“极性”或“非极性”),分子中有个δ键、个π键. A6H6分子中A原子的杂化轨道类型是杂化.
(2)当n=3时,A与B形成的晶体属于晶体.
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种原子的电负性由大到小的顺序是(用元素符号表示);A、C、D三种元素的第一电离能由大到小的顺序是(用元素符号表示).
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O.该配合物中的中心离子钴离子
在基态时的核外电子排布式为.作为配位体之一的NH3分子的空间构型为
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为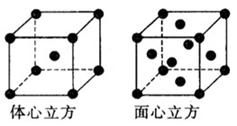
【化学与技术】
氯碱工业中曾用石棉隔膜电解槽来电解食盐水,下图即为石棉隔膜电解槽的示意图,回答下列问题:
(1)产物A是;产物B是;产物C
(2)石棉隔膜能阻止不能通过,但不能阻止通过。
(3)粗盐水含Ca2+、Mg2+、SO42-等杂质离子,这些离子的存在除了会影响电解所得产品的纯度外,主要会所以电解食盐水要求对粗盐水进行精制,请将精制时除去上述三种离子通常加入的化学试剂按加入的顺序依次写来,形成沉淀过滤后,还应加入盐酸调节pH,过滤所需要的玻璃仪器有
已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如下图,(部分反应产物已略去).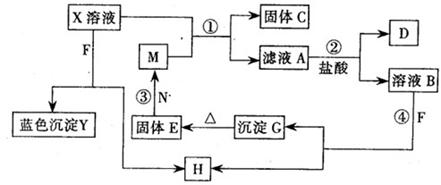
请回答下列问题;
(1)E的化学式为
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是:
(3)在反应①②③④中属于置换反应的是(填序号).
(4)反应②的离子方程式为
(5)用石墨作电极电解500mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1. 6g.请回答下列问题:
①写出电解时的阳极反应式
②电解后溶液的pH为假设电解前后溶液体积不变)