我国钛铁矿(主要成分为FeTiO3,还含有Al2O3、SiO2等)的储量居世界首位,用钛铁矿制取TiO2和副产品硫酸亚铁晶体的的流程如下: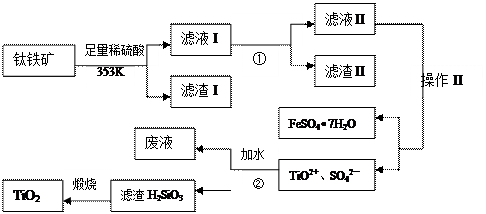
已知:Al(OH)3的Ksp= 1.3ⅹ10-33,Fe(OH)2的Ksp= 1.6ⅹ10-14。
(1)滤液I主要含有TiO2+、SO42—、Fe2+、 (填离子符号);
(2)调节PH应最好使用 ;
| A.Fe | B.Ca(OH)2 | C.NH3•H2O | D.NaOH |
(3)操作II是指 洗涤、干燥。
(4)步骤②中发生的化学反应方程式为: ;考虑成本和废物综合利用等因素,生产过程中产生的废液中应加入 处理较合理。
(5)实验室通常将硫酸亚铁进一步制备为硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]以利保存,制备方法被收入中学《实验化学》教材中;专家测定晶体含量的办法是:准确称取m g产品溶解定容至250.00ml,移取25.00ml于锥形瓶中,用c mol·L-1的标准KMnO4溶液滴定至 ,记录消耗KMnO4溶液的体积为V mL;此时发 生的反应为:
生的反应为:
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O,(已知硫酸亚铁铵晶体的相对分子质量为3 92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。
92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。
某学习小组依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
| SO2Cl2 |
Cl2 |
SO2 |
|
| 熔点/℃ |
–54.1 |
–101 |
–72.4 |
| 沸点/℃ |
69.1 |
–34.6 |
–10 |
| 性质 |
遇水发生剧烈水解 |

(1)若用浓盐酸与高锰酸钾为原料制取Cl2,反应的离子方程式为______________;
(2)B仪器的作用是________________;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为____。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________________。
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li+SO2Cl2 = 2LiCl+SO2,则电池工作时,正极的电极反应式为__________________。
某待测液中可能含有Ba2+、Fe3+、K+、Fe2+、CO32-、Cl-等离子,进行如下实验:
①取适量待测液于试管中,加入稀H2SO4,有白色沉淀生成;
②过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现;
③在步骤②中的溶液中,继续滴加氯水,溶液立即变红。
根据实验现象回答:
(1)待测液中一定含有的离子是 ,一定不含有的离子是 ;
(2)还有一种离子不能确定是否存在,要确认这种离子的实验方法和现象是 。
右图为实验室某浓盐酸试剂瓶上的标签,
试根据有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L稀盐酸。
①该学生用量筒量取________ mL上述浓盐酸进行配制;
②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有 。
③下列操作导致所配制的稀盐酸的物质的量浓度偏低的是 (填字母)。
| A.用量筒量取浓盐酸时俯视凹液面 |
| B.未恢复到室温就将溶液注入容量瓶并进行定容 |
| C.容量瓶用蒸馏水洗后未干燥 |
| D.定容时仰视液面 |
E、未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为 mol/L。
a.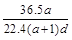 b.
b.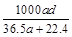 c.
c. d.
d.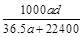
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。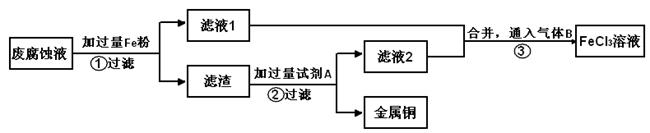
学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
Ⅱ、步骤③通入的气体B是 (填化学式),写出该反应的离子方程式: 。
分析下列反应:3S+6 KOH = 2K2S+K2SO3+3H2O,据此作答:
(1)用双线桥标出该反应中电子的转移方向和数目:3S +6 KOH = 2K2S+K2SO3+3H2O
(2)该反应的氧化产物是 。
(3)该反应的氧化剂与还原剂的质量比是 。
(4)当消耗0.3 mol S时,则转移的电子数是 。