根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 |
A |
B |
C |
D |
E |
| 原子半径/nm |
0.186 |
0.143 |
0.089 |
0.104 |
0.074 |
| 主要化合价 |
+1 |
+3 |
+2 |
+6、-2 |
-2 |
| A.C2+与B3+的核外电子数不相等 |
| B.单质与稀盐酸反应的速率A<B |
| C.最高价氧化物对应水化物的碱性A<C |
| D.氢化物的稳定性H2D<H2E |
下列离子方程式书写正确的是
| A.三氯化铁溶液中加入铁粉:Fe3+ + Fe ═ 2Fe2+ |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH— ═ Al(OH)3↓ |
| C.苯酚钠溶液中通入少量CO2:CO2 + H2O + C6H5O-→ C6H5OH + HCO3- |
| D.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl— = Mn2++Cl2↑+2H2O |
下列说法中正确的是
| A.CH3CH2OH、SO3和水分别属于非电解质、强电解质和弱电解质 |
| B.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
| C.煤油可由石油分馏获得,可用于保存少量金属钠 |
| D.工业上金属Mg、Al都是用电解其相应的氯化物水溶液制得的 |
氢化锂(LiH)属于离子化合物。LiH跟水反应可以放出氢气。下列叙述中正确的是
| A.LiH的水溶液显中性 |
| B.LiH中的氢离子可以被还原生成氢气 |
| C.LiH是一种强氧化剂 |
| D.LiH中氢离子比锂离子的半径大 |
下列离子在指定条件下能大量共存的是
| A.在酸性溶液中:Ba2+、K+、SO32―、Cl― |
| B.含有大量Al3+的溶液中:K+、Na+、NH4+、SO42― |
| C.使甲基橙变黄的溶液中:Na+、I―、CO32―、OH― |
| D.无色溶液中:K+、Cl―、Cr2O72-、HCO3― |
下列实验“实验操作”与“结论”对应关系正确的是
| 选项 |
实验操作 |
结论 |
| A |
向Fe(NO3)2溶液的试管中加入稀H2SO4 ,在管口观察到红棕色气体 |
HNO3分解生成了NO2 |
| B |
向沸水中逐滴加入1~2 mL FeCl3饱和溶液,煮沸至红褐色液体 |
制备Fe(OH)3胶体 |
| C |
常温下,向饱和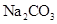 溶液中加少量 溶液中加少量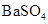 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下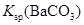 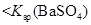 |
| D |
向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 |
酸性:盐酸>碳酸>苯酚 |