某探究小组用测量HNO3 与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂:
与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂:
l.00 mol·L-1 HNO3、2.00 mol·L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴
(1)他们能完成哪些因素对速率影响的探究? 。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验
| 实验编号 |
T/℃ |
大理石规格 |
HNO3浓度/mol·L-1 |
| ① |
常温 |
|
2.00 |
| ② |
|
|
1.00 |
| ③ |
|
|
2.00 |
| ④ |
|
|
2.00 |
(3)整个实验中应控制的不变量是 。
(4)该实验小组用下图实验装置进行实验,
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必
需的实验仪器还有 。
②干燥管中应放置的试剂是 。
| A.碱石灰 | B.无水CaCl2 |
| C.P2O5固体 | D.浓硫酸 |
③若撤除干燥管装置,所测速率 (填偏大、
偏小或不变)。
(7分)(1)写出下图中序 号①~④仪器的名称:
号①~④仪器的名称: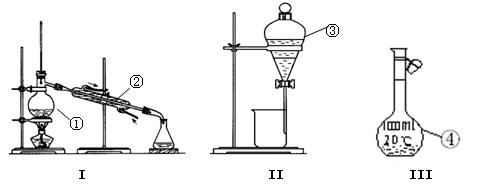
①;②;③;④;
(2)仪器①~④中,使用时必须检查是否漏水的有。(填仪器序号)
(3)分离碘水中的碘应选择装置II进行和操作(填操作名称)。
(6分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液法 B、加热分解C、结晶法D、分液法E、蒸馏法F、过滤法
(1)分离饱和食盐水和沙子的混合物;
(2)分离水和苯的混合物;
(3)分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶。
(12)某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。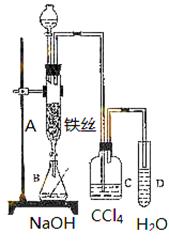
(1)A中铁丝发生如下反应2Fe+3Br2=2FeBr3,FeBr3的作用是,请写出A中另外一个反应的化学方程式。
(2)观察到 A中的气体颜色是由______色变成_______色。
A中的气体颜色是由______色变成_______色。
(3)实验结 束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________________________。
束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________________________。
(4)C中盛放CCl4的作用是____________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应的方法是验证是否有HBr的生成,故而可向试管D中滴入石蕊溶液,若溶液变红,则能 证明。另一种验证的方法是向试管D中加入__________,现象是__________________________________________。
证明。另一种验证的方法是向试管D中加入__________,现象是__________________________________________。
下列有关实验的叙述,正确的是(填序号)
| A.用98%的浓硫酸配制100g10%的稀硫酸溶液时,除使用量筒外还需用到容量瓶 |
| B.用渗析法分离淀粉中混有的NaNO3杂质 |
| C.无法用分液漏斗将乙二醇和水的混合液体分离 |
| D.用浓氨水洗涤做过银镜反应的试管 |
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.用酸式滴定管量取20.00mL 0.1000mol/L的KMnO4溶液
G.用托盘天平称取10.50g干燥的NaCl固体
H.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
I.用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物
J.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
31.某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭)。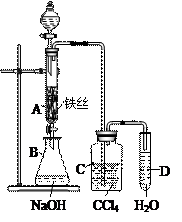
(1)写出A中反应的化学方程式:
(2)观察到A中的现象是:
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是:
(4)C中盛放CCl4的作用是
(5)证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入,现象是