(15分)某同学在学习了氨的性质以后,运用类比的思想思考:(1)其他气体在一定情况下能否像氨气一样也形成喷泉?(2)氨气具有还原性,能否像H2那样还原CuO呢?于是他设计实验制取氨气并探究上述问题。请你参与他的活动并完成下列研究:
(Ⅰ)制取氨气及喷泉现象的探究
1.写出实验制取氨气的化学方程式 ;
2.收集氨气的方法是 。
3.喷泉是一种常见的自然现象。
(1)图1为化学教材中的喷泉实验装置。该生积极思考,只要满足烧瓶内压强与玻璃管水柱压强的和小于烧瓶外的压强就可以产生喷泉。于是他设计了图2和图3所示的装置。
①在图2的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是__________。
A.Cu和稀盐酸 B.NaHCO3与NaOH溶液 C.MnO2与稀盐酸 D.Na2CO3与稀盐酸
②在图3锥形瓶中加入易挥发物质(如酒精),水槽中加入冷水后,再加入下列的物质足量,结果也产生了喷泉。水槽中后加入的物质可以是___________。
A.浓硫酸 B.食盐 C.生石灰 D.蔗糖
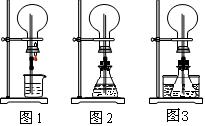
(2)城市中常见的人造喷泉及火山爆发的原理与上述___________(从“图1”或“图2”中选择)装置的原理相似。
(Ⅱ)该小组中某同学设计了下列所示的实验
装置(夹持及尾气处理装置未画出),探究氨气
的还原性:
|
|
|
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。
(12分) 某实验小组用下图装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是反应(放热或吸热)。
(2)甲和乙两个水浴作用不相同。甲的作用是;
乙的作用是。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是,
集气瓶中收集到的气体的主要成分是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可先在混合液中加入(填写字母)。然后,再通过(填实验操作名称)即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
(3分)下列实验操作不正确的 是________。
是________。
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯 |
| B.用酸性高锰酸钾溶液检验苯中混有的甲苯 |
| C.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇 |
| D.向试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡、静置,待液体分层后,滴加硝酸银溶液
丁烷催化裂解生成烷烃和烯烃,可按下列两种方式进行:
C4H10→C2H4+C2H6;C4H10→C H4+C3H6
某化学兴趣小组为了测定丁烷裂解气中CH 和C
和C H
H 的比例关系,设计实验如下图所示:
的比例关系,设计实验如下图所示:
如图连接好装置后,需进行的操作有:①给 D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
注:CuO能将烃氧化成CO 和H
和H O;A
O;A l
l O
O 是烷烃裂解的催化剂;G后面装置已省略。
是烷烃裂解的催化剂;G后面装置已省略。
(1)这三步操作的先后顺序是_________(填序号)
(2)简要叙述证明空气已排尽的操作方法______________________。
(3)假定丁烷完全裂解,且流经各装置中的气体能完全反应。当装置E和F的总质量比反应前增加了0.7g,G装置中固体质量比反应前减少了1.76g,则在丁烷的裂解产物中
CH 和C
和C H
H

 的物质的量之比n(CH
的物质的量之比n(CH ):n(C
):n(C H
H )=______________。
)=______________。
(4)若对实验后E装置中的混合物再按以下流程进行实验:

①分离操作I、Ⅱ的名称分别是:I、_____________,Ⅱ、____________。
②Na SO
SO 溶液的作用是______________________。
溶液的作用是______________________。
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有 溶液的棉花。给试管加热,观察现象。当反应一段时间以后,停止加热。回答下列问题:
溶液的棉花。给试管加热,观察现象。当反应一段时间以后,停止加热。回答下列问题: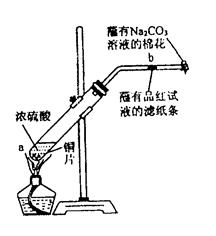
(1)写出a处反应的化学方程式,
浓硫酸所体现的作用是性。
(2)试管中的液体反应一段时间后,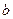 处滤纸条的变化为。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
处滤纸条的变化为。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(3)待试管中液体冷却后,取试管上层液体加入一支试管中,再慢慢加入少量水,可观察溶液呈色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是
(5)如果浓硫酸的浓度为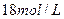 ,铜片是过量的,加热使之反应,当被还原的硫酸为
,铜片是过量的,加热使之反应,当被还原的硫酸为 。则浓硫酸的实际体积(填写“大于”、“等于”或“小于”)
。则浓硫酸的实际体积(填写“大于”、“等于”或“小于”) 。
。
甲、乙、丙、丁四位同学各取了0.1 mol·L-1的一元酸(他们所取的酸可能是不同的)20.00 mL,分别向其中滴加0.1 mol·L-1的一元碱(他们所用的碱也可能是不同的),在滴加过程中不断测定混合液的pH,下表是测得的部分数据。
| 测定溶液的pH |
||||
| 加入碱溶液的体积/mL |
甲 |
乙 |
丙 |
丁 |
| 19.98 |
4.3 |
7.7 |
4.3 |
|
20.0 0 0 |
7.0 |
7.0 |
8.7 |
5.3 |
| 20.02 |
9.7 |
10.0 |
请回答下列问题:
(1)为了较方便准确地量取所用的酸,甲同学量取酸液时左手拿洗耳球,右手所持的玻璃量器是(填该量器的名称),向酸溶液中滴加碱溶液时,所用的仪器是。
(2)分析表中的数据,有一个数据肯定是错误的,该数据是,在回答以下问题时都应该剔除该数据。
(3)四位同学所选用的酸溶液pH最大的是(在甲、乙、丙、丁中选填)。
(4)请计算甲同学在滴入19.98 mL 碱溶液时,溶液的pH约为(保留一位小数,也可用对数形式表示)。
(5)若以上酸碱用于中和滴定,试给出选用指示剂的建议(填在表格中)
| 甲 |
乙 |
丙 |
丁 |
|
| 建议选用的指示剂 |