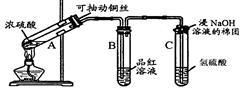
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作为 。如何确定E中空气已被赶尽 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。
(3)如何证明E中收集到的是NO而不是H2? 。
一段时间后,C中白色沉淀溶解,其原因是 。
(4)装置D的作用是 。
根据下图所示实验回答下列问题:
 (1)试管C口部的棉团上发生反应的离子方程式是 。
(1)试管C口部的棉团上发生反应的离子方程式是 。 (2)试管B中的实验现象是 ,若将该试管中反应后的溶液加热,可以观察到 。试管C中溶液变浑浊,则证明SO2具有 性。
(2)试管B中的实验现象是 ,若将该试管中反应后的溶液加热,可以观察到 。试管C中溶液变浑浊,则证明SO2具有 性。 (3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是 ,如果浸NaHCO3溶液,则发生反应的化学方程式是 。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是 ,如果浸NaHCO3溶液,则发生反应的化学方程式是 。
某学习小组对教材实验“在200mL烧杯中放人20 g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15 mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究。



 (1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。压缩“黑色面包”时,感觉较硬,放在水中呈漂浮状态。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。压缩“黑色面包”时,感觉较硬,放在水中呈漂浮状态。 同学们由上述现象推测出下列结论:
同学们由上述现象推测出下列结论: ①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③蔗糖炭化得到的碳连成整体,碳原子间形成了化学键 ④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③蔗糖炭化得到的碳连成整体,碳原子间形成了化学键 ④浓硫酸具有酸性 ⑤黑色物质具有强吸附性 其中依据不充分的是 (填序号);
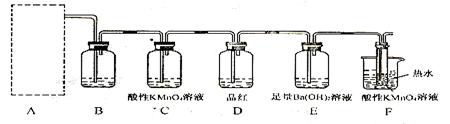
其中依据不充分的是 (填序号); (2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
 试回答下列问题:
试回答下列问题: ①上图A中应选用下列装置 (填编号)。
①上图A中应选用下列装置 (填编号)。
 ②B装置所装试剂是 ;D装置中试剂的作用是
②B装置所装试剂是 ;D装置中试剂的作用是 ;E装置中发生的现象是 ;
;E装置中发生的现象是 ; ③A装置中使蔗糖变黑的化学反应方程式为 ;
③A装置中使蔗糖变黑的化学反应方程式为 ; ④F装置中酸性高锰酸钾溶液颜色变浅的原因是
④F装置中酸性高锰酸钾溶液颜色变浅的原因是 ;其反应的离子方程式是 。
;其反应的离子方程式是 。
研究性学习小组进行SO2的制备及性质探究实验。 (1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。
(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。 ①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
 ②实验过程中,使用分液漏斗滴加浓硫酸的操作是 。
②实验过程中,使用分液漏斗滴加浓硫酸的操作是 。 (2)将SO2气体分别通入下列溶液中:
(2)将SO2气体分别通入下列溶液中: ①品红溶液,现象是 ;
①品红溶液,现象是 ; ②溴水溶液,现象是 ;
②溴水溶液,现象是 ; ③硫化钠溶液,现象是 。
③硫化钠溶液,现象是 。 (3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。 ①原因 ,验证方法 。
①原因 ,验证方法 。 ②原因 ,验证方法 。
②原因 ,验证方法 。 ③原因 ,验证方法 。
③原因 ,验证方法 。
某学生课外活动小组利用右图所示装置分别做如下实验:
 (1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。 (2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
某无色溶液中只可能含有①Na+ 、②Ba2 +、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液的pH大于7 |
| (2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
| (3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是()
| A.肯定含有的离子是①④⑤ | B.肯定没有的离子是②⑤ |
C.可能含有的离子是①⑥ | D.不能确定的离子是③⑥ |