实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因。
[分析与猜想]
(1)根据过氧化钠与水反应的原理:2Na2O2 + 2H2O =" 4NaOH" + O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色。由此提出如下的猜想:
A.氧气有漂白性
B.氢氧化钠有漂白性
C.
[实验与判断] 请完成下列表格:
| 实验编号 |
1 |
2 |
3 |
| 实验装置 |
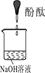 |
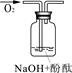 |
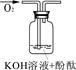 |
| 验证猜想 |
|
C |
|
| 实验现象 |
溶液变红后不退色 |
||
| 实验说明 |
1、2的实验中NaOH溶液是用 (填“氢氧化钠固体”、“氧化钠固体”、“过氧化钠固体”)溶于水配制的。 |
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。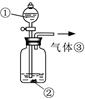
A.酚酞试剂 B.过氧化钠与水反应后的溶液
C.二氧化锰 D.氢氧化钠固体配制的溶液
(4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。
硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成的。某校化学研究性学习小组用类比学习思想,并通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
【实验探究】取适量Na2S2O3晶体,溶于水制成Na2S2O3溶液,进行如表所示的探究,完成表中有关内容。
【实验结论】探究① 探究② 。
根据探究①和探究②的结论,Na2S2O3和Na2SO4化学性质 。
【问题讨论】
(1)甲同学向探究②反应后的溶液中滴加AgNO3溶液,出现白色沉淀,据此甲同学认为氯水可将Na2S2O3氧化。你认为此方案是否正确并说明理由: 。
(2)请你重新设计一个实验方案,证明Na2S2O3能被氯水氧化。你设计的方案是 。
如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。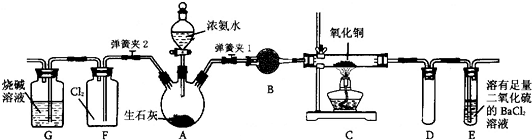
(1)在组装好装置后,若要检验A—E装置的气密性,其操作是首先 ,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好。
(2)装置B中盛放试剂是 。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生 (答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式 。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量。若反应前固体质量为16g,反应后称重固体质量减少2.4g。通过计算确定该固体产物的成分是 (用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。写出产生白烟的化学方程式 。迅速产生倒吸的原因是 。
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-==LixC6。现利用以下工艺流程回收正极材料中某些金属资源(部分条件未给出)。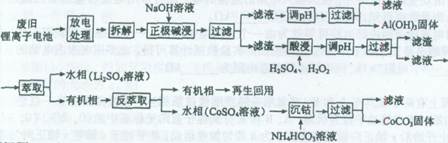
(1)LiCoO2中,Co元素的化合价为______。
(2)写出“正极碱浸”中发生反应的离子方程式____________________。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式____________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是__________。
(4)写出“沉钴”过程中发生反应的化学方程式__________________________。
(5)充放电过程中,发生LiCoO2与LixCoO2之间的转化,写出放电时电池反应方程式___________________。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是__________________。在整个回收工艺中,可回收到的金属化合物有_________________(填化学式)。
工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A______________B____________。
(2)实验室提纯粗盐的实验操作依次为:
取样、__________、沉淀、__________、__________、冷却结晶、__________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是__________________。
碳酸化时没有析出碳酸钠晶体,其原因是______________________.
(4)碳酸化后过滤,滤液D最主要的成分是______________(填写化学式),检验这一成分的阴离子的具体方法是:______________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:____________________________。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:__________(注明你的表达式中所用的有关符号的含义)。
(2013)氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为 .
(2)加入H2O2氧化时,发生反应的化学方程式为 .
(3)滤渣2 的成分是 (填化学式).
(4)煅烧过程存在以下反应:
2MgSO4+C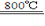 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C  MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C  MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.
①D中收集的气体可以是 (填化学式).
②B中盛放的溶液可以是 (填字母).
a.NaOH 溶液 b.Na2CO3溶液c.稀硝酸d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: .