水的电离平衡曲线如图所示,下列说法不正确的是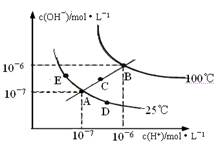
| A.图中五点KW的大小比较:B>C>A=D=E |
| B.若温度不变在水中加入少量的酸可从A点到D点 |
| C.若向水中加入适量的NaOH溶液可从A点到C点 |
| D.在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性 |
某元素原子的质量数为A,它的阳离子Xn+核外有x个电子,w克这种元素的原子核内中子数为
A.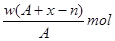 |
B.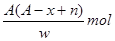 |
C.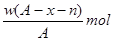 |
D.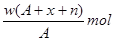 |
下列物质能通过化合反应直接制得的是
①FeCl2 ②H2 SO4③NH4Cl④NO
| A.只有①②③ | B.只有②③④ | C.只有①③④ | D.全部 |
下列图示的装置属于原电池的是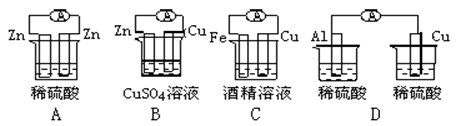
右图是可逆反应X2 + 3Y2 2Z2在反应过程中的反应速率(V)与时(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(V)与时(t)的关系曲线,下列叙述正确的是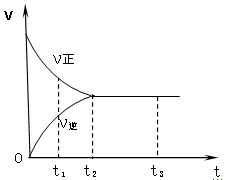
| A.t1时,只有正方向反应 |
| B.t2时,反应到达限度(或平衡) |
| C.t2- t3,反应不再发生 |
| D.t2- t3,各物质的浓度相等 |
一定条件下,反应N2+3H2 2NH3,在2L密闭容器中进行,5min内氨物质的量增加了0.1mol,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨物质的量增加了0.1mol,则反应速率为
| A.v(H2)=0.03mol/(L·min) | B.v(N2)=0.02mol/(L·min) |
| C.v(NH3)=0.1mol/(L·min) | D.v(NH3)=0.01mol/(L·min) |