恒压密闭容器中充入2 mol X和5 mol Y,发生反应:X(g)+3Y(g) 2Z(g),温度分别为T1和T2时,X的转化率α(X) 随时间变化的关系如图。下列结论正确的是
2Z(g),温度分别为T1和T2时,X的转化率α(X) 随时间变化的关系如图。下列结论正确的是
| A.该反应正反应吸热 |
| B.达到平衡后,其它条件不变,通入稀有气体,平衡向正反应方向移动 |
| C.达到平衡后,其它条件不变,降低温度,正逆反应速率均减小,Z的体积分数也减小 |
| D.在T2℃时,若开始加入1mol X、3mol Y和2mol Z,达到平衡后α(X)>0.25 |
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是
| A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B.X、Z两元素能形成原子个数比(X︰Z)为3︰1和4︰2的化合物 |
| C.化合物YW2、ZW2都是酸性氧化物 |
| D.用M单质作阳极,石墨作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |
右图装置可用来监测空气中NO的含量,下列说法正确的是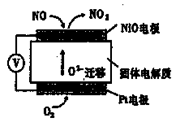
| A.电子由Pt电极流出,经外电路流向NiO电极 |
| B.Pt电极上发生的是氧化反应 |
| C.NiO电极的电极反应式为NO+O2--2e-=NO2 |
| D.每流经1 m3空气(假设NO被完全吸收),转移电子的物质的量为2×10-7mol,则该空气中NO的含量约为3×10-2mg/m3 |
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(kJ)是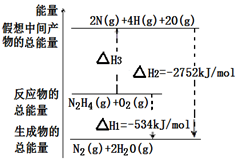
| A.194 | B.391 | C.516 | D.658 |
把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)下列对该反应的说法不正确的是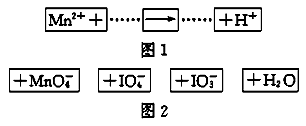
| A.IO4作氧化剂 |
| B.若有1molMn2+参加反应转移5mol电子 |
| C.氧化剂与还原剂的物质的量之比为5:2 |
| D.配平后Mn2+、H+的化学计量数分别为2、3 |
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入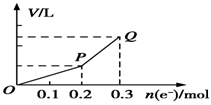
| A.0.1molCuO | B.0.1molCuCO3 |
| C.0.1molCu(OH)2 | D.0.05molCu2(OH)2CO3 |