现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。已知
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3- +I2 = 2IO3- + Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由
。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值
为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 ;阴极观察到的现象是 ;
四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:


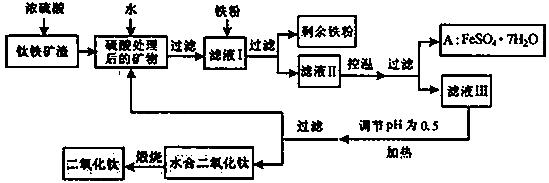
请回答下列问题:


(1)硫酸与二氧化钛反应的化学方程式是____________________________________。
(2)向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行: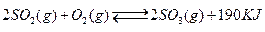
1)该反应所用的催化剂是___(填写化合物名称),该反应450℃时的平衡常数 _____500℃时的平衡常数(填“大于”、“小于”或“等于”)。
2)该热化学反应方程式的意义是____________
a.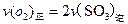 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20 mol 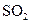 和0.10mol
和0.10mol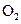 ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含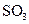 0.18mol,则
0.18mol,则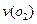 =______
=______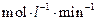 :若继续通入0.20mol
:若继续通入0.20mol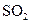 和0.10mol
和0.10mol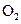 ,则平衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(
,则平衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(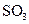 )<______mol。
)<______mol。
烃的含氧衍生物A,能发生如下图所示的变化。在同温同压下,A蒸气的密度是H2密度的66倍,其中氧元素的质量分数为12.1%;B的化学式为C9H8O2;C能使溴的四氯化碳溶液褪色,与Na反应放出H2;D不含甲基,在一定条件下能发生消去反应。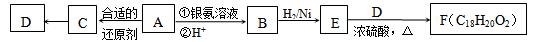
请填写下列空白:
(1)A分子中的含氧官能团的名称为,C的结构简式是。
(2)C→D的反应类型是(填标号)。
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(3)D+E→F的化学方程式是。
(4)与D分子式相同,其中能与金属钠反应且苯环上有一个取代基(包括D)的同分异构体
有种,写出其中一种含有2个甲基的结构简式
(5)A~F六种化合物中:
①除C外,能与金属钠反应,但不能与氢氧化钠溶液反应的是(填标号,下同);
②燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为11:9:5的是。
在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g)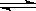 CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
850 |
1000 |
1200 |
| K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g)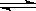 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2O ( mol/L) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
 钛(Ti )被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
钛(Ti )被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白: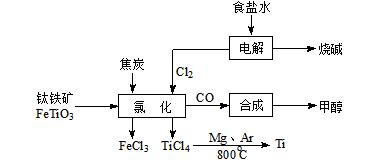

 (l)电解饱和食盐水时,总反应的离子方程式是。
(l)电解饱和食盐水时,总反应的离子方程式是。 (2)写出钛铁矿经氯化法得到四氯化钛的化学方程。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程。 (3)已知:①Mg(s) + Cl2(g)=MgCl2(s)△H =-641kJ·mol-1
(3)已知:①Mg(s) + Cl2(g)=MgCl2(s)△H =-641kJ·mol-1 ②Ti(s) + 2Cl2(g)=TiCl4(s)△H = -770kJ·mol-1
②Ti(s) + 2Cl2(g)=TiCl4(s)△H = -770kJ·mol-1 则2Mg(s) + TiCl4(s)=2MgCl2(s) + Ti(s)△H=。
则2Mg(s) + TiCl4(s)=2MgCl2(s) + Ti(s)△H=。 反应2Mg(s) + TiCl4(s)
反应2Mg(s) + TiCl4(s)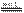 2MgCl2(s) + Ti,在Ar气氛中进行的理由是: ______________________________________。
2MgCl2(s) + Ti,在Ar气氛中进行的理由是: ______________________________________。
 (4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是。