现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V 型。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。
型。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。
请回答下列问题(填空时用实际符号):
(1) C的元素符号是 ;元素 F在周期表中的位置 。
F在周期表中的位置 。
(2) B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为 ,其固体时的晶体类型是 。
(3) 最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右所示。科学家最近又用脉冲激光烧蚀CCl4又发现了C2分子。根据以上信息,下列说法正确的是 。
① C4属于一种新型的化合物
② C4沸点比P4(白磷)低
③ C4与C2互为同素异形体
④ C4稳定性比P4(白磷)差
⑤ C4属于原子晶体
⑥ C4和P4 (白磷)的晶体都属于分子晶体
⑦ C4与C2互为同分异构体
(4) C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为 ,其空间构型为 。
(5) 为了除去化合物乙(A2ED4)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:
(6) E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是 。
a .E2F2的结构式为:F- E—E- F
b. E2Br2与E2F2结构相似,熔沸点:E2Br2 < E2F2
c. E2F2与H2O反应的化学方程式可能为:2 E2F2+2H2O=EO2↑+ 3E↓+4HF
(1)某建筑材料,主要成分为铝硅酸盐,化学式是MgAl2H4Si4O14;化学式改写成氧化物形式为_________。该材料与酸或碱反应时可以看作各氧化物分别与酸、碱反应,则材料该与足量的氢氧化钠反应后过滤,滤渣主要是_______。
(2)除去镁粉中混有的铝粉(用离子方程式表示)。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。原因是(用化学方程式表式)
(4)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g。则放出H2的体积为升(标况下)
(5)标准状况下把11.2L氯气通入500ml0.8mol/LFeBr2溶液中,写出反应完全后的离子方程式
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应: 2SO2(g)+O2(g)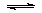 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式:。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式:、。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是。
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=kJ·mol-1。
SO3(g)+NO(g)的ΔH=kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 | D.每消耗1molSO3的同时生成1mol NO |
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K=。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是:。
(3)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
①该电池工作时,OH-向极移动(填“正”或“负”)。
②该电池正极的电极反应式为。
I.下列说法不正确的是(填字母代码)。
A.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡 Al3++3OH-,前者为溶解平衡,后者为电离平衡 |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C.能源、信息与材料通常被称为现代社会发展的三大支柱 |
| D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
E.除去硬水中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2溶解度比 MgCO3的小
II.向含有AgI的饱和溶液中:
(1)加入固体AgNO3,则c(I-)(填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+)。
(3)若改加AgCl固体,则c(I-),而c(Ag+)。
III.用“>”、“<”或“=”填空:
(1)25℃时1mol/L FeCl3溶液的pH80℃时1mol/L FeCl3溶液的pH。
(2)已知NaHSO3溶液中c(HSO3-)>c(SO32-)>c(H2SO3),则溶液中c(H+)c(OH-)。
(3)常温下,取等物质的量浓度的HA溶液与NaOH溶液等体积混合,测得混合溶液的pH=8,混合溶液中由水电离出的c(H+)水NaOH溶液中由水电离出的c(H+)水。
某溶液中含有Ba2+,Cu2+, Ag+,现用NaOH溶液、盐酸和Na2CO3溶液将这三种离子逐一沉淀分离。其流程图如所示
(1)沉淀的化学式(写出最佳答案):
沉淀1,沉淀3;
(2)写出溶液+B的离子方程式:。