张明同学设计下图所示装置,用粗铁粒与1890g·L-1(质量分数10%)的硝酸反应制取NO气体。请回答有关问题。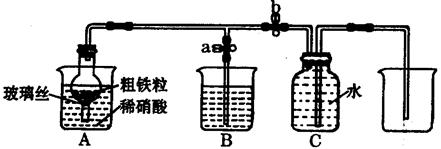
①1890g·L-1硝酸的物质的量浓度为 。
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是 。
③当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是 。B装置烧杯中液体的作用是 。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
④该实验中,若去掉B装置,对实验结果是否有影响? 。
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是 (用含a和b的代数式表示)。
⑥完全反应后,A装置烧杯里含铁的价态可能是 。现有仪器和药品:试管和胶头滴管。0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性KMnO4溶液、氯水等。请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 |
操作 |
现象与结论 |
| 第一步 |
取少量液体装于试管,向试管中滴入几滴KSCN溶液 |
|
| 第二步 |
|
若溶液紫色退去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
某化学兴趣小组将两份等质量的硫粉分别在空气、氧气中燃烧,放出的热量是一样多还是不一样多?经过讨论、综合,根据观点分成了两组。
A组:在该过程中参加反应的硫与氧气量相等,反应物和生成物具有的能量都相等,故放出的热量相等。
B组:硫粉在氧气中燃烧比在空气中更剧烈,故在氧气中燃烧放出的热量多。
在老师的帮助下,他们决定用实验来探究其真相,在常温(25℃)下,实验过程如下(不考虑环境的影响):
①称取质量相等的两份硫粉;
②取一份硫粉放在燃烧匙中,伸入弹式量热计(剖面示意图如上)的密封器中;
③在密封器中充满空气的条件下,用电火花引燃,测出反应后内层中水的最高温度为t1;
④取另一份硫粉放在燃烧匙中,在密封器中充满氧气的条件下,用电火花引燃,测出反应后内层中水的最高温度为t2;
回答下列问题:
(1)若A组观点正确,则t1________t2(填“<”、“>”或“=”);
(2)根据实验所测数据显示:t1>t2,这说明结论与________(填“与A组观点”、“B组观点”或“都不”)符合;若填都不符合,那么哪种情况放出热量多?________________;
(3)请对t1>t2这一现象做出合理的解释:_________________________________________________;
(4)通过这个实验同时说明,当条件相同、反应物与生成物的量相同时,反应放出或吸收的热量多少与反应的剧烈程度________(填“有关”或“无关”)。
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:(1)选用的指示剂是。
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,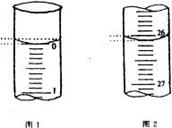
请将数据填入下面表格的空白处。
| 滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000 mol/L 盐酸的体积/ mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
| 第一次 |
25.00 |
|||
| 第二次 |
25.00 |
2.00 |
28.08 |
26.08 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(5)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(6)滴定终点的判定依据是。
某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略): 
查阅资料可知,HSO3- 的酸性强弱与H2CO3相近。请回答下列问题:
(1)装置A中发生反应的化学方程式是:A
(2)上述装置的接口连接顺序依次是a→→→→→g→h→d(填导管接口字母)。
(3证明SO2具有氧化性的现象是;证明SO2具有还原性的实验中,反应的离子方程式是。
(4)C试管中NaOH溶液的作用是,CCl4的作用是。
(本小题14分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。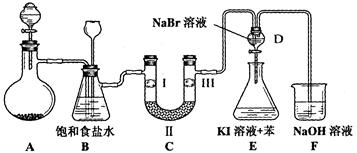
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:________________________。
(2)装置B中饱和食盐水的作用是________________________________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入__________。
| A |
B |
C |
D |
|
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_______________________________。
(5)某同学建议将装置F中的药品改用足量的NaHSO3溶液吸收余氯,老师认为不妥,用总反应的离子方程式解释原因_____________________________________。
(12分)某化学课外小组为测定空气中CO2的含量,进行了如下实验:
(1)配制0.100 0 mol·L-1和0.010 00 mol·L-1的标准盐酸。
(2)用0.100 0 mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL。
(3)用测定的Ba(OH)2溶液吸收定量空气的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里,加水至刻度线。取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
(4)过滤上述所得浊液。
(5)取滤液20.00 mL,用0.010 00 mol·L-1的盐酸滴定,用去盐酸34.80 mL。请回答下列问题:
①配制标准盐酸时,需用下列哪些仪器________;
| A.托盘天平 |
| B.容量瓶 |
| C.酸式滴定管 |
| D.量筒 |
E.烧杯
F.胶头滴管
G.玻璃棒
②滴定操作中,左手__________,右手__________,眼睛________________________。
③Ba(OH)2溶液的物质的量浓度是________________________________________;
④过滤所得浊液的目的是_________________________________________________;
⑤此空气样品中含CO2的体积分数为______________________________________。