某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:(1)选用的指示剂是 。
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,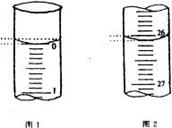
请将数据填入下面表格的空白处。
| 滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000 mol/L 盐酸的体积/ mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
| 第一次 |
25.00 |
|
|
|
| 第二次 |
25.00 |
2.00 |
28.08 |
26.08 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(5)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(6)滴定终点的判定依据是 。
某一化学反应的实验装置如图所示: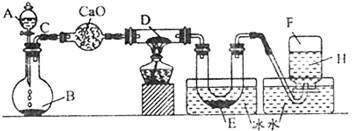
注:A—H属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氯水、水、锌粒、铜片、氯化钙、氧化钙、四氧化三铁、氧化铜、氢气、二氧化碳、二氧化氮、氯气、氯化氢、氨气、氮气、氧气。
实验现象:①D物质由黑色变为红色;②无水硫酸铜粉末放入无色透明的E中得到蓝色深夜;③点燃的镁条伸入无色无味的F中,镁条继续燃烧,将生成的物质放入水中,有气体放出,并有白色浑浊物形成,该气体具有刺激性气味,并能使润湿的红色石蕊试纸变蓝。通过分析回答:
|
(1)写出下列标号的物质名称:
A ;B ;D ;E ;F 。某校化学实验兴趣小组为“证明某水煤气中CO2、CO 、H2 H2O(气)共同存在”。经讨论从以下提供的仪器和药品中设计组合成一套装置(假设其它杂质气体对本实验无干
扰)
(1)该小组证明CO2存在应选用_▲_装置,现象是:_▲_。证明H2O气的存在应选用_▲_装置,现象是:_▲_。
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略。按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:混合气体—( )—( )—( B )—( )—( )—( )
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?_▲_。
工业“从海水中提取镁”的流程图如下:
其步骤为:
①将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg。
请回答以下问题:
⑴步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有、、酒精灯、铁架台等。
⑵步骤④中的“一定条件”指的是,目的是。
⑶上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
。
⑷有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?
你的观点是。理由是
。
甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
测定原理:KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。
4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O
2MnO4―+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
测定装置:部分装置如下图所示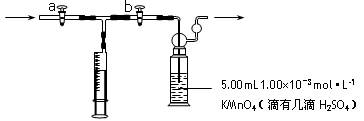
I.测定步骤:
①用量取5.00mL 1.00×10-3mol·L-1 KMnO4溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
③打开,关闭(填“a”或“b”),用注射器抽取100mL新装修的房屋室内空气。关闭,打开(填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次所取的高锰酸钾溶液均为5.00mL)。3次实验所消耗草酸溶液的体积平均值为12.38mL。
II.交流讨论:⑴计算该居室内空气中甲醛的浓度mg·m-3,该居室的甲醛(填是或否)超标。
⑵某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及滴定实验均无错误)提出合理假设:_____________________________________(至少答出2种可能性)。
⑶实验结束后,该小组成员在相互交流的过程中一致认为:
①实验装置应加以改进。
有同学提议:可将插入KMnO4溶液的管子下端改成具有多孔的球泡(如下图),有利于提高实验的准确度,其理由是。
②实验原理可以简化。实验中无需用草酸标准液滴定,可直接抽取室内空气,再压送到洗气瓶中,直至_________________________________________。
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl  SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在l000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点—84.7℃),提纯SiHCl3采用的方法为 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):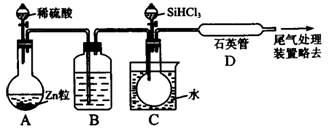
①装置B中的试剂是 。装置C中的烧瓶需要加热,其目的是
。
②反应一段时间后,装置D中观察到的现象是 ,
装置D不能采用普通玻璃管的原因是 ,
装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检验实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液