科学研究发现纳米级的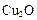 可作为太阳光分解水的催化剂。
可作为太阳光分解水的催化剂。
Ⅰ.四种制取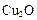 的方法
的方法
(1)火法还原。用炭粉在高温条件下还原CuO;
(2)用葡萄糖 还原新制的
还原新制的 。写出化学方程式 ;
。写出化学方程式 ;
(3)电解法。反应为 。则阳极产物是 ;
。则阳极产物是 ;
(4)最新实验研究用肼( )还原新制
)还原新制 可制备纳米级
可制备纳米级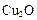 ,同时放出
,同时放出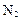 。该制法的化学方程式为 。
。该制法的化学方程式为 。
Ⅱ.用制得的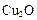 进行催化分解水的实验
进行催化分解水的实验
(1)一定温度下,在2L密闭容器中加入纳米级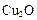 并通入0.10mol水蒸气,发生反应:
并通入0.10mol水蒸气,发生反应: ;△H= +484kJ/mol,不同时段产生
;△H= +484kJ/mol,不同时段产生 的量见下表:
的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
计算:前20min的反应速率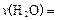 ;达平衡时,至少需要吸收的光能为 kJ。
;达平衡时,至少需要吸收的光能为 kJ。
(2)用以上四种方法制得的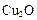 在某相同条件下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。
在某相同条件下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。
A.c、d方法制得的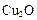 催化效率相对较高 催化效率相对较高 |
B.d方法制得的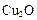 作催化剂时,水的平衡转化率最高 作催化剂时,水的平衡转化率最高 |
C.催化效果与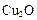 颗粒的粗细、表面活性等有关 颗粒的粗细、表面活性等有关 |
| D.Cu2O催化水分解时,需要适宜的温度 |
电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板蚀刻液。某探究小组设计如下线路处理废液和资源回收:
请回答:
(1)FeCl3—HCl溶液蚀刻铜板后的废液中含有的金属阳离子是。
(2)FeCl3蚀刻液中加入盐酸的目的:可以,又可提高蚀刻速率。
(3)步骤①中加入H2O2溶液的目的是。
(4)已知:生成氢氧化物沉淀的pH
| Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
4.7 |
7.0 |
1.9 |
| 沉淀完全时 |
6.7 |
9.0 |
3.2 |
根据表中数据推测调节pH的范围是。
(5)写出步骤②中生成CO2的一个离子方程式_____(已知Cu2(OH)2CO3不易溶于水)。
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式___________________。
某化学探究小组拟用废铜屑制取Cu(NO3)2:,并探究其化学性质。
I.如图,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液。
(1)写出铜与浓硝酸反应的离子方程式。
(2)①装置中NaOH溶液的作用是。
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、、过滤。
③你认为此装置是否合理,并说明原因。
如果不合理,同时在原装置上改进;如果合理,只需说明原因。
Ⅱ.为了探究 的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
【实验操作及现象】往试管中放人研细的无水Cu(NO3)2:晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体。
【解释与结论】
(3)①红棕色气体是。
②根据现象判断 在加热条件下可以分解,其化学反应方程式为。
在加热条件下可以分解,其化学反应方程式为。
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3·Cu(OH)2]。
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品。
【实验数据】反应温度对样品的影响
| 实验序号 |
1 |
2 |
3 |
4 |
| 温度/℃ |
35 |
50 |
70 |
95 |
| 样品颜色 |
深蓝色 |
深蓝色 |
浅绿色 |
暗蓝色 |
| 样品中碱式碳酸铜 的质量分数/% |
90.9 |
92.7 |
x |
92.0 |
(4)滤液中可能含有 ,写出检验
,写出检验 的方法。
的方法。
(5)95℃时,样品颜色发暗的原因:____。
(6)70C时,实验得到2.38 g样品,取此样品加热至分解完全(杂质不分解),得到1.76 g固体,此样品中碱式碳酸铜的质量分数是。
50 mL 0.5 mol·L—1盐酸与50 mL 0.55 mol·L—1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热(中和热是指酸和碱中和生成1 mol H2O所放出的热量)。
(1)从实验装置上看,图中尚缺少的一种用品是_________________________。
(2)烧杯间填满碎纸条的作用是____________________________________。
(3)若大烧杯上不盖硬纸板,求得中和热数值将_________(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L—1盐酸跟50 mL 0.55 mol·L—1,NaOH溶液进行反应。
与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热的数值_________(填“相等”或“不相等”),理由是___________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_________(填“偏小”、“偏大”或“无影响”)。
为了证明一水合氨(NH3·H2O)是弱电解质,常温下,甲、乙两人分别选用下列试剂进行实验:0.01 mol·L—1氨水、0.1 mol·L—1NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.01 mol·L—1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?____(填“是”或“否”),并说明理由。
(2)请你根据所提供的试剂,再提出一个合理又简便的方案,证明NH3·H2O是弱电解质。
H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题: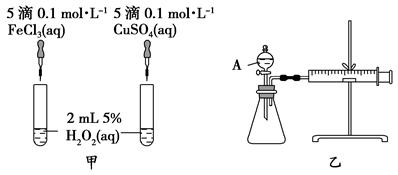
(1)定性分析:图甲可通过观察____________,定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_____________ 。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_________,检查该装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看,实验中需要测量的数据是_____________________________________。
(3)加入0.1 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
写出H2O2在MnO2作用下发生反应的化学方程式_________________________。
②A、B、C、D各点反应速率由大到小的顺序为__________。
③反应速率由D到A逐渐变化的原因是:随着反应的进行,反应物浓度逐渐________,(填 “增大”或“减小”)反应速率逐渐_________。(填 “加快”或“减慢”)
④计算H2O2的初始物质的量浓度为________ mol/L。(保留两位有效数字)