H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题: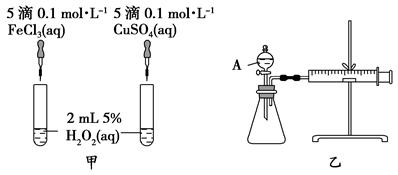
(1)定性分析:图甲可通过观察____________,定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_____________ 。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_________,检查该装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看 ,实验中需要测量的数据是_____________________________________。
(3)加入0.1 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
写出H2O2在MnO2作用下发生反应的化学方程式_________________________。
②A、B、C、D各点反应速率由大到小的顺序为__________。
③反应速率由D到A逐渐变化的原因是:随着反应的进行,反应物浓度逐渐________,(填 “增大”或“减小”)反应速率逐渐_________。(填 “加快”或“减慢”)
④计算H2O2的初始物质的量浓度为________ mol/L。(保留两位有效数字)
实验室里用下列药品和仪器来制取纯净的无水氯化铜: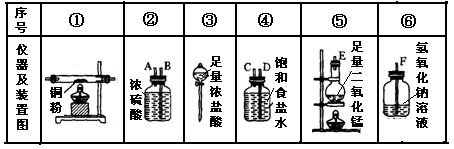
图中A、B、C、D、E、F的虚线部分表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。
(1)如果所制得气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)
接接接接接;
其中,②与④装置相连时,玻璃管接口(用装置中字母表示)应是接。
(2)装置⑥中发生反应的离子方程式是。
(3)实验开始时,应首先检验装置的;实验结束时,应先熄灭处的酒精灯。
(4)在装置⑤的烧杯中,发生反应的化学方程式为。
(5)待充分反应后,装置①的玻璃管中呈色。冷却后,将制得的产物配成溶液,溶液呈色。
(6)若反应中有71gCl2生成,则被氧化的HCl的物质的量为,转移电子数为。
某化学实验小组的同学利用乙醇和浓硫酸制备乙烯气体并验证乙烯的某些化学性质。步骤如下:
①在一蒸馏烧瓶中加入约20mL乙醇和浓硫酸(体积比为1∶3),再加入少量的碎瓷片;
②瓶口插上带温度计的橡皮塞;
③加热并迅速使反应温度上升到170℃;
④气体通过稀NaOH溶液进行洗气后,分别通人酸性KMnO4溶液和溴水中。
据此回答下列问题:
(1)写出实验室制备乙烯的化学方程式:______。
(2)在反应液中加入少量碎瓷片的作用是_________。
(3)步骤②中温度计水银球的正确位置是___________________________________。
(4)步骤③加热时,若反应温度不能迅速升高到170℃会产生一种有机副产物,写出该物质的名称_____。
(5)将乙烯(除杂后)通人酸性KMnO4溶液中,观察到的现象是;通人溴水中发生反应的化学方程式是。
某化学创新实验小组设计了如图示实验装置来制取溴苯并证明该反应为取代反应。已知:溴苯的熔点为‒30.8℃,沸点156℃。
(1)三颈烧瓶中发生的有机反应化学方程式;
(2)仪器A的名称;本实验使用仪器A的原因。而在实验室实际实验时并没有使用A的原因是。
(3)锥形瓶中小试管内CCl4作用;如不加该部分装置将导致什么结果。
(4)分液漏斗内的NaOH溶液作用:。
为了综合利用副产品CaSO4,某化工厂与相邻的合成氨厂联合设计了下列(NH4)2SO4生产流程: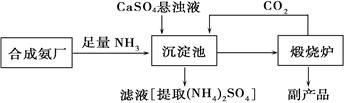
请回答以下问题:
(1)合成氨反应的化学方程式是,该反应在(填设备名)中发生,反应所用催化剂一般用。
(2)沉淀池中发生的主要反应方程式是,该反应能够发生的原因是。
(3)在上述流程中可以循环使用的物质是,该生产过程中的副产品是。
(4)从绿色化学和资源综合利用的角度说明上述流程的主要优点是。
三个化学小组的同学测定某Na2CO3固体样品(仅含NaOH杂质)的纯度,他们提出了各自的气体分析法。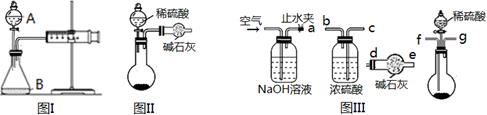
(1)第一小组用图I所示装置,仪器A的名称。把m1 g的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时需检查该装置气密性,具体的操作方法是。
(2)第二小组用图II装置测定CO2的质量。该装置存在明显缺陷是:。
(3)第三小组在第二小组装置的基础上,解决了第二小组装置的问题。所用到的仪器如图III,装置的连接顺序是a—(填写接口字母,图中仪器可重复使用)。实验中取了样品m1 g,称量干燥管质量为m2 g,与足量稀硫酸反应后称量干燥管质量为m3 g,则Na2CO3的纯度表达式为。