【化学——选修3:物质结构与性质】目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:

(1)基态铜原子的外围电子层排布为________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________cm。((用含d和NA的式子表示)。

某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm |
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____________________________ ______;
(2)操作中锥形瓶下垫一张白纸的作用是___________________________________________;
(3)判断到达滴定终点的实验现象是_________________________________ ____;
(10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察____________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________________________________________________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式
____________________________________________________________________。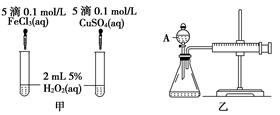
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是___________________________________________________________。
检查乙装置气密性的方法是
____________________________________________________________________。
(3) 0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________。
(4) 在一定温度下,反应:2A(s)+2B(g) 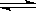 C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
| A.容器内的压强不随时间而变化 |
| B.混合气的密度不再随时间而变化 |
| C.A的质量不再改变 |
| D.平衡混合气体的平均相对分子质量不再改变 |
某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】 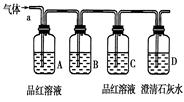
猜想1:______________________________,
猜想2:______________________________,
猜想3:______________________________。
为了验证猜想,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入,则:
(1) B中可以装下列________试剂(填编号)。
| A.NaCl溶液 | B.KMnO4溶液 |
| C.盐酸 | D.澄清石灰水 E.NaHCO3 溶液 F.碘水 |
(2) A中品红溶液的作用是:_________________________________。
(3) D中澄清石灰水的作用是:_________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色③D中澄清石灰水变浑浊
【得出结论】
(4) 由上述现象该小组同学确认该气体的成分为:______________________。
(5) 请写出SO2与氯水发生反应的离子方程式:_________________________。
(本小题满分14分)某研究性学习小组欲验证红热的炭与浓硫酸发生反应所生成的各种产物,按气体的流动方向设计了如下实验流程:
(1)①中反应的化学方程式为 ;
(2)②处的现象是: 。
(3)品红溶液使用了两次,第一次使用时的作用是
第二次使用时的作用是________________ _。
(4)二氧化硫也能使溴水褪色,表现了二氧化硫的 性。(“还原”、“漂白”)
反应的化学方程式为: 。
(5)根据 现象,可证明产物中一定有CO2气体
(本小题满分9分)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:

(1)实验1甲针筒内的现象是:有___________生成,针筒活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(2)实验2中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为____________________。
(3)实验3中,已知:3Cl2+2NH3===N2+6HCl。甲针筒处活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。