(16分)铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)(1)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;腐蚀废液回收得到金属铜还需要的试剂为 。
(2)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(3)下表中,对陈述I、II及其有无因果关系的判断,都正确的是_____(填字母)
| 选项 |
陈述I |
陈述II |
判断 |
| A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
I对;II对;有 |
| B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
I对;II对;无 |
| C |
铁属于过渡金属元素 |
铁和铁的某些化合物可以用作催化剂 |
I错;II对;无 |
| D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
I对;II对;有 |
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:


已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(3)步骤②中加双氧水的目的是 ,pH控制在3. 4的作用是 。已知25°C时, ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净?___________________________
(5)制备氮化铁磁粉的反应: (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
下图为苯和液溴取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。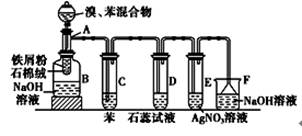
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式:______________________________________________________。
(2)试管C中苯的作用是_________________________;反应开始后,观察D和E试管,看到的现_______________________________;__________________________________。
(3)反应2 min至3 min后,在B中的NaOH溶液可观察到的现象是
______________________________________________________________。
(4)在上述整套装置中,具有防倒吸的仪器有____________________(填字母)。
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是__________________________________________。
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题: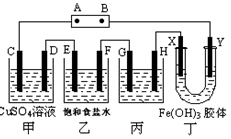
(1)电源A 极的名称是___________
(2)甲装置中电解反应的总化学方程式是____________________________
(3)如果收集乙装置中产生的气体,两种气体的体积比是__________。
(4)欲用丙装置给铜镀银,G应该是___(填“铜”或“银”),电镀液的主要成分是(填化学式)。
(5)装置丁中的现象是
工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)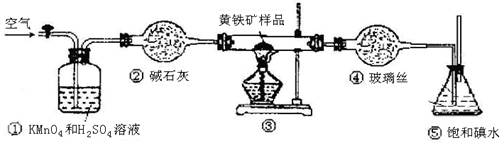
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+ 8SO2如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是。
(2)步骤G中所用主要仪器是,应取(填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是。
(4)步骤H中滴定时应选用作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
| 滴定次数 |
待测液体的体积/mL |
标准碱溶液的体积/mL |
|
| 滴定前 |
滴定后 |
||
| 第一次 |
20.00mL |
0.00 |
20.58 |
| 第二次 |
20.00mL |
0.22 |
20.20 |
| 第三次 |
20.00mL |
0.36 |
20.38 |
则硫铁矿样品中硫元素的质量分数为(保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
以海水中常见的物质A为原料可以发展很多种工业,下图中包含了几种基本工业生产,请根据各物质之间的转化关系。回答下列问题:
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为__________________________。
(2)将F和J通入A的饱和溶液中的顺序为_______________。
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
(3)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
①检验沉淀是否洗涤干净所用到的试剂是______________________
②样品中NaCl的质量分数的数学表达式为__________________________
某研究性学习小组研究HNO3的氧化性,设计了如下实验:在盛有新配制FeS04溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴人几滴浓HN 03,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色突然变为蓝色,并产生红棕色气体。这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
(1)实验室粗略配制一定质量分数的硫酸亚铁溶液的方法是:将一定质量的绿矾(FeS04·7H2 0)置于烧杯中,__________________________。
(2)提出假设:
甲同学认为是FeS04与HN03作用
乙同学认为是KSCN与HNO3作用
(3)根据乙同学的观点,设计了如下实验方案进行验证:向浓HN03中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体。继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通人过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(该气体是空气中的主要成分之一);向反应后的溶液中加入BaC12溶液产生白色沉淀。
写出向浓HNO3中滴入KSCN溶液反应的离子方程式:__________________
丙同学认为还应设计K2S04溶液与浓硝酸作用的实验,他的理由是__________________
(4)延伸探究:丁同学认为SCN-的性质还应进一步探究,查资料发现:(SCN)2是一种“拟卤素”,与C12、Br2有相似的性质。他据此设计了以下方案:向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色。请写出Fe(SCN)3与氯气反应的离子方程式:。
(5)通过本次探究,可以得出以下结论:
a、用SCN -间接检验Fe2+时加入氧化剂应注意(填“少量”、“过量”);
b、与SCN-反应使溶液变红的不一定是Fe3+