二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下: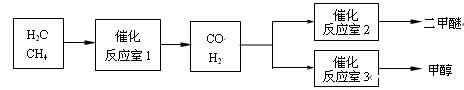
请填空:
(1)在一定条件下,反应室1(假设容积为10L)中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),起始时按体积比1:2充入CH4和水蒸气,经过一段时间反应达到平衡状态,平衡时混合气的压强比起始时增大20%,则CH4的转化率为 。
CO(g)+3H2(g),起始时按体积比1:2充入CH4和水蒸气,经过一段时间反应达到平衡状态,平衡时混合气的压强比起始时增大20%,则CH4的转化率为 。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在一定条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)  CH3OH(g) △H ,CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g) △H ,CO的平衡转化率与温度、压强的关系如图所示,则: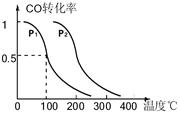
① P1 P2 , △H_____0 (填“<”、“>”或“=”)。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”) 。
③在P1压强下,100℃时,反应放出的热量为QkJ,则该条件下此反应的热化学方程式______________________________________。
盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性。试用化学方程式分别表示盐碱地产生碱性的原因:,及用石膏降低其碱性的反应原理:。
请判断下列说法是否正确(填“对”或“错”)。
(1)碱性锌锰电池是一次电池,铅蓄电池是二次电池。
(2)随着温度的升高,纯水的pH增大。
(3)冰醋酸、纯碱、小苏打分别属于酸、碱、盐。
(4)镀锌铁制品破损后,镀层仍能保护铁制品。
(5)醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度。
(6)25 ℃时,某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐。
(7)用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓
(8)pH=2与pH=1的硝酸中c(H+)之比为1:10
(9)Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
(10)向含有硫酸钙的水垢中加入碳酸钠溶液,沉淀的转化可表示为:
CaSO4(s)  SO42— + Ca2+
SO42— + Ca2+
CO32— CaCO3(s)
CaCO3(s)
常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于。
(1)酸性溶液c(H+)(填“>”、“<”或“=”,下同)c(OH-),pH 7。
人的胃液中含有盐酸,经测定某人胃液的pH为2,则其中的c(H+)=mol/L。
食醋常用于食品调味,其主要成分为醋酸,醋酸的电离方程式为。
(2)室温下,pH均为3的盐酸和醋酸溶液,下列各项中相等的是(填序号)。
①溶液中c(H+)②酸的物质的量浓度③完全中和时,消耗NaOH的质量
(3)在①NaCl、②CH3COONa、③NH4Cl三种盐溶液中,常温下呈酸性的是(填序号,下同)), 呈中性的是, 呈碱性的是。
(4)氯化铁水解的离子方程式为,配制氯化铁溶液时滴加少量盐酸的作用是。
25℃时,现有浓度均为0.10 mol/L的两种溶液:① (NH4)2SO4溶液、② Na2SO4溶液。请回答:
(1)两种溶液中,pH<7的是(填“①”或“②”),其原因是(用离子方程式表示)。
(2)下列说法正确的是(填序号)。
① (NH4) 2SO4是弱电解质
② (NH4) 2SO4和Na2SO4均能促进水的电离
③两种溶液等体积混合后,溶液中离子浓度大小关系为:c(Na+)= c(SO42-)>c(NH4+)>c(H+)>c(OH-)
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。这个原电池的负极是,电极反应式是;
正极是,电极反应式是。