混合动力车在刹车和下坡时处于充电状态;上坡或加速时,电动机提供辅助推动力,降低了汽油的消耗。该车一般使用的是镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)电解液。镍氢电池充放电原理如图,其总反应式为:H2+2NiOOH = 2Ni(OH)2。下列有关判断正确的是( )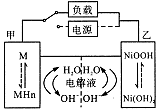
| A.在刹车和下坡时,甲电极的电极反应式为:2 H2O+2e- |
| B.在上坡或加速时,溶液中的K+向甲电极迁移 |
| C.在刹车和下坡时,乙电极增重 |
| D.在上坡或加速时,乙电极周围溶液的pH将减小 |
下列离子方程式书写正确的是
| A.铝粉投入氢氧化钠溶液中:2Al+2OH- |
| B.氯化铝溶液中加入足量的氨水:Al3++3NH3·H2O |
| C.氯化铁溶液中加入铁粉:Fe3+ +Fe |
D.碳酸钙与盐酸反应: CO +2H+ +2H+ |
下图所示的实验操作,不能达到相应目的的是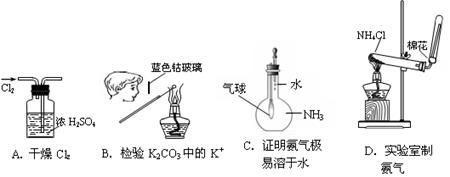
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.常温常压下,48gO3含有的氧原子数为3NA |
| B.1.8g的NH4+离子中含有的电子数为0.1NA |
| C.常温常压下,11.2 L氧气所含的原子数为NA |
| D.2.4g金属镁变为镁离子时失去的电子数为0.1NA |
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是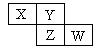
| A.X的气态氢化物比Y的稳定 |
| B.W的最高价氧化物对应水化物的酸性比Z的强 |
| C.Z的非金属性比Y的强 |
| D.X与Y形成的化合物都易溶于水 |
在一条件下,反应N2+3H2 2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
| A.1.2mol/(L·min) | B.1.0 mol/(L·min) |
| C.0.6 mol/(L·min) | D.0.4 mol/(L·min) |