在一条件下,反应N2+3H2 2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
| A.1.2mol/(L·min) | B.1.0 mol/(L·min) |
| C.0.6 mol/(L·min) | D.0.4 mol/(L·min) |
氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和1/2O2+H2O+2e-=2OH-,则下列叙述正确的是()
| A.通H2的一极是正极,通O2的一极是负极 |
| B.通O2的一极是正极,通H2的一极是负极 |
| C.工作一段时间后电解质溶液pH增大 |
| D.工作时负极区附近pH减小 |
表明金属甲比乙的活动性强的叙述不正确的是()
| A.甲能与稀盐酸反应生成H2而乙不能 |
| B.将甲、乙组成原电池,甲为负极 |
| C.在氧化还原反应中甲比乙失去电子多 |
| D.在氧化还原反应中甲比乙容易失去电子 |
将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各叙述正确的是()
| A.正极附近SO42—的浓度逐渐增大 | B.负极附近SO42—的浓度逐渐减小 |
| C.负极附近SO42—的浓度逐渐增大 | D.正极附近SO42—的浓度基本不变 |
如下图的装置能构成原电池并产生较强的电流的是()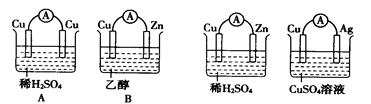
原电池工作时()
| A.正极发生氧化反应 | B.负极发生氧化反应 |
| C.电子从正极流出 | D.负极质量一定减轻 |