X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示(部分反应条件略去)。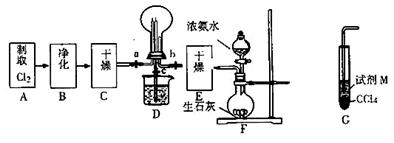
请回答下列问题:
(1)Z元素的原子结构示意图为 。
(2)A的电子式为 ,D的化学式为 。
(3)E通过 反应可以生成C(填序号,有一个或多个选项符合题意)。
a.分解 b.复分解 c.氧化还原 d.置换
(4)写出下列反应的化学方程式:① ,③ 。
(5)A和E化合生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为 。
镍是有机合成的重要催化剂,某化工厂有含镍催化剂废品(主要成分是镍、杂质是铁、铝单质及其化合物,还有少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 |
开始沉淀 |
完全沉淀 |
| Al(OH)3 |
3.8 |
5.2 |
| Fe(OH)3 |
2.7 |
3.2 |
| Fe(OH)2 |
7.6 |
9.7 |
| Ni(OH)2 |
7.1 |
9.2 |
回答下列问题:
(1)溶液①中含金属元素的离子是_________________。
(2)用离子方程式表示加入双氧水的目的___________;双氧水可以用下列物质替代的是_______。
A.氧气 B.漂白液 C.氯气 D.硝酸
(3)操作a和c需要共同的玻璃仪器是_____________;操作C的名称是______________。
(4)如果加入双氧水量不足或“保温时间较短”,则所制备的产品可能含有的杂质为_____________;请选择合适的试剂,设计实验证明产品中是否含“杂质” ______________。
(5)含镍金属氢化物MH-Ni燃料电池是一种绝色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M  MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为什么2NO+2CO 2CO2+N2。在密闭容器中发生该反应时,随温度(T)和时间(t)的变化曲线如图所示。
2CO2+N2。在密闭容器中发生该反应时,随温度(T)和时间(t)的变化曲线如图所示。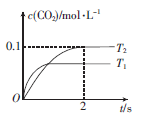
①T1_________(填“>”“<”或“=”)T2。
②在T2温度下,0~2s内的平均反应速率v(N2)=____________________。
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________。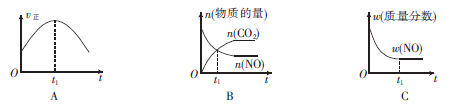
(2)NH3催化还原氮氧化物(SCR)技术是目前应用广泛的烟气氮氧化物脱除技术。用Fe作催化剂时,在氨气足量的情况下,不同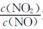 对应的脱氮率如图所示。
对应的脱氮率如图所示。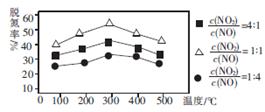
脱氮效果最佳的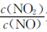 =________。此时对应的脱氮反应的化学方程式为_______________。
=________。此时对应的脱氮反应的化学方程式为_______________。
(3)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。该电池在使用过程中石墨I电极上生成N2 O5,其电极反应式为_____________。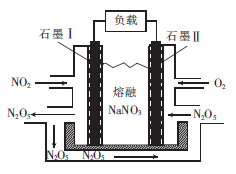
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是______________________________,过滤时需用到的玻璃仪器有烧杯、_______________________。
(2)写出碳酸镍与稀硫酸反应的离子方程式:_____________________。
(3)硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n) Fe2 O4。如图表示在其他条件相同时合成氨的相对初始速率随催化 剂中n值变化的曲线,由图分析可知Co2+、 Ni2+两种离子中催化效果更好的是_________。
(4)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:__________________________。
氧硫化碳(COS)可替代磷化氢而被用作蒸剂。
(1)组成氧硫化碳和磷化氢的各元素中,原子半径最大的元素是___________________(填元素符号)。
(2)下列事实可用于比较C与P两种元素非金属性相对强弱的是____________(填字母)。
a.最高正化合价:P>C
b.同温同浓度的两溶液的酸性:H3PO4>H2CO3
c.沸点:PH3>CH4
(3)氧硫化碳水解及部分应用流程如下(部分产物已略去):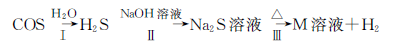
①已知:常温下,反应Ⅱ中每吸收1.7g H2S气体,反应放出热量4.76kJ,则该反应的热化学方程式为____________________。
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为___________。
某待测液中可能含有大量Mg2+、Fe3+、K+、H+、NO3-、SO42-、OH-离子中的一种或几种,现通过下实验进行检验:
①取少量待测液,仔细观察,呈无色;
②向上述待测液中滴加NaOH溶液,开始阶段无明显现象,后来有白色沉淀生成,
③向上述待测液溶液中加入BaCl2溶液,无现象。
(1)据此可以判断该待测液中一定大量存在的离子是 ,一定不能大量存在的离子是 ,不能确定是否存在的离子是 。
(2)依次写出②中加入氢氧化钠溶液后的离子反应方程式 , 。