氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
已知:Br2是易挥发、深红棕色的液体;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
(1)反应室①中发生反应的化学方程式为 。
(2)反应室①使用冰水的目的 。
(3)操作I的名称 ,操作Ⅱ用到的玻璃仪器有 。
(4)反应室②中加入Na2SO3的目的是 。
(5)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
②乙同学假设工业氢溴酸呈淡黄色是因为 ,其用于证明该假设成立的方法为 。
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
①在步骤a中,还需要通入氧气和水,其目的是.
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在范围。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的 原因是。
原因是。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是。
(3)在硝酸铜溶液中,各种离子浓度由大到小的顺序是。
过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下: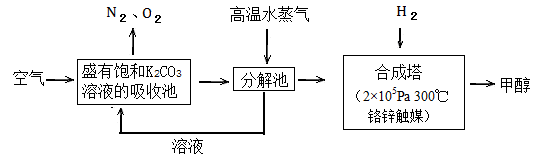
(1)写出吸收池中主要反应的离子方程式;
在合成塔中,若有2.2kgCO2与足量H2 恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式。当电子转移的物质的量为时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。
某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)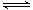 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=;此时在B点时容器的体积VB10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高 CO转化率可采取的措施是 (答出两点即可)。
(答出两点即可)。
D、E为中学化学常见的金属单质,F是一种黑色晶体。E与C的浓溶液在常温作用无明显现象,加热时则有大量无色气体产生,同时生成H。在一定条件下C、D间能发生反应。各物质转化关系如下图: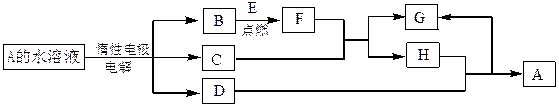 (1)B的同素异形体的名称为_________;F的化学式为__________。
(1)B的同素异形体的名称为_________;F的化学式为__________。
(2)写出D与C的浓溶液反应的化学方程式。
(3)用惰性电极电解A 溶液的阳极反应式为____________。
(4)检验H和G的混合溶液中含有G的阳离子的试剂可以是_________。
a.氯水和KSCN溶液 b.氢氧化钠溶液 c. 酸性KMnO4溶液
(5)用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为_____________mol, 收集到标准 状况下的气体体积为_____________。
状况下的气体体积为_____________。
有机物A~F之间的转化关系如下图所示(部分产物已略去),其中B的相对分子质量是D的2倍。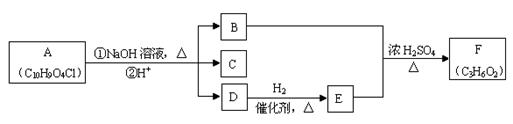
提示: 会自动脱水形成R—CHO
会自动脱水形成R—CHO
根据以上信息回答下列问题:
⑴B的分子式是
⑵检验D中官能团可 使用的试剂名称是,写出D的相邻同系物与该试剂反应的化学方程式______________________________________________________。
使用的试剂名称是,写出D的相邻同系物与该试剂反应的化学方程式______________________________________________________。
⑶C遇FeCl3溶液显紫色,核磁共振氢谱中有四个峰,其峰面积比为1:2:2:1。写出
C的结构简式_____________________。
⑷符合下列条件的C的同分异构体共有种。
①苯环上存在对位取代基;②遇FeCl3溶液显紫色;③能与银氨溶液反应。
⑸写出A的结构简式__________________________。
⑹若1molA 和足量NaOH反应,最多能消耗___________mol NaOH。
和足量NaOH反应,最多能消耗___________mol NaOH。
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为,W3分子的空间结构为;
(2)X单质与水发生主要反应的方程式为;
(3)化合物M的化学式为,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳 酸二甲酯分子中,碳原子采用的杂化方式有
酸二甲酯分子中,碳原子采用的杂化方式有 ,O-C-O的键角约为;
,O-C-O的键角约为;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z=;
(5)含有元素Z的盐的焰色反应为色。许多金属盐都可以发生焰色反应,其原因是。