氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。与反应生成和的热化学方程式为。
(2)热分解制氢时,常向反应器中通入一定比例空气,使部分燃烧,其目的是;燃烧生成的与进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:。
(3)的热分解也可得到,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中表示的物质依次是。

(4)电解尿素[]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为.

(5)是一种储氢合金。350℃时,与反应,生成和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。与反应的化学方程式为。
(1)(广东)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)===3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)===6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)===P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)===CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江苏)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g)ΔH1=+64.39 kJ·mol-1
②2H2O2(l)===2H2O(l)+O2(g)ΔH2=-196.46 kJ·mol-1
③H2(g)+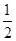 O2(g)===H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)===H2O(l)ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______。
保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示: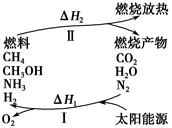
过程Ⅰ可用如下反应表示:
①2CO2 2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O
2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O 4NH3+3O2 ④2CO2+4H2O
4NH3+3O2 ④2CO2+4H2O 2CH3OH+3O2 ⑤2CO+4H2O
2CH3OH+3O2 ⑤2CO+4H2O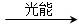 ________+3O2
________+3O2
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)请完成第⑤个反应的化学方程式:____________________。
(3)上述转化过程中,ΔH1和ΔH2的关系是________。
(4)断裂1 mol化学键所需的能量见下表:
| 共价键 |
H—N |
H—O |
N≡N |
O===O |
| 断裂1 mol化学键所需能量/(kJ·mol-1) |
393 |
460 |
941 |
499 |
常温下,N2与H2O反应生成NH3的热化学方程式为_________。
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族二~五周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1 c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:____________________________________;由R生成Q的化学方程式为________________________________________________________。
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2。请回答:
(1)元素C在周期表中的位置是________。
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式________________________________。
(3)D和E两种元素相比较,其原子得电子能力较强的是________(写名称)。
以下说法中,可以证明上述结论的是__________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是____________________________。
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X________Y(填“>”、“=”或“<”)。
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100 mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2 mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为________。
下表列出了A~R十种元素在周期表中的位置:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
E |
R |
F |
||||
| 3 |
A |
C |
D |
H |
I |
G |
|
| 4 |
B |
请回答下列问题:
(1)写出R单质分子的电子式________。
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是________(填化学式)。
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为________(用元素的离子符号表示)。
(4)写出A的单质与水反应的化学方程式_____________________________。
(5)X元素是A~R十种元素中的一种,X的原子核里有14个中子,2.7 g X在氧气里燃烧时,质量增加2.4 g。X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应。X的元素符号是________,它位于元素周期表中第________周期第________族。