下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;乙溶液 ;丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
(1)光导纤维的主要成分是_________(填化学式)。碱性溶液不能用带玻璃塞的试剂瓶盛装的原因是(用离子方程式说明)______________。
(2)漂白粉的有效成分是_______________(填物质名称),其漂白原理是(用化学方程式表示)___________。
(Ⅰ)四种短周期元素A、B、C、D的性质或结构信息如下:
①原子半径:A>B>C>D
②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲: 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二
乙: 无色,无气味并且易燃.是常见的一种基础能源
无色,无气味并且易燃.是常见的一种基础能源
丙: 有强氧化性的弱酸,可以用于消毒杀菌
有强氧化性的弱酸,可以用于消毒杀菌
请根据上述信息回答下列问题.
(1)B元素在周期表中的位置第二周期_______________,请写出BC2分子的结构式_____________。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂.E单质与甲反应有化合物X生成.请写出以下两个反应的离子方程式:
①A元素的单质与物质甲发生的离子反应方程式_____________________。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的离子反应方程式为_________________________。
(Ⅱ)某研究小组将CaCl2和H2在一定条件下反应,制得两种化合物(甲和乙).元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性.请回答下列问题:
(1)甲的电子式是_________________。
(2)甲与乙溶液反应可得H2,其化学方程式是_____________________。
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)+49.0kJ
某科学实验将6mol CO2和8mol H2充入一容积为2L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标):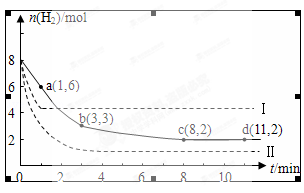
回答下列问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)
a.0~1min b.1~3minc.3~8mind.8~11min
(2)该反应在0~8min内CO2的平均反应速率是 mol/(L•min).
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示.与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
(4)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
在一定体积的密闭容器中,进行如下化学方程式:
CO(g)+H2O(g) CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.5 |
回答下列问题:
(1)该反应化学平衡常数的表达式为K= 。
(2)该反应为 (填“放热”或“吸热”)反应。
(3)能判断该反应是否达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ(正,H2)=υ(逆,H2O)D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。试判断此时的温度为 ℃。
如右图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol·L-1。经过 60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因(用化学方程式表示)是: 。
(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为 。
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,下同);容器内N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。