A.原子序数小于36的、、、四种元素,其中是形成化合物种最多的元素,原子基态时最外层电子数是其内层电子数的2倍,原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)分子中原子轨道的杂化类型为,1含有键的数目为。
(2)化合物的沸点比化合物的高,其主要原因是。
(3)元素的一种氧化物与元素的一种氧化物互为等电子体,元素的这种氧化物的分子式是。
(4)元素的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是,它可与浓盐酸发生非氧化还原反应,生成配合物,反应的化学方程式为。

B.草酸是一种重要的化工产品。实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)

实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65与98%的质量比为2:1.5)溶液
③反应3左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
↑↑
↑
↑
(1)检验淀粉是否水解完全所需用的试剂为
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是
(3)装置用于尾气吸收,当尾气中=1:1时,过量的溶液能将,全部吸收,原因是用化学方程式表示)
(4)与用溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是。
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有 。
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到12.6g白色沉淀,向所得的浊液中逐滴加入3mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示: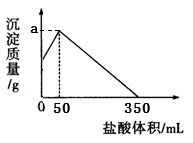
根据题意回答下列问题:
(1)写出将NaOH、AlCl3、MgCl2溶于水时发生反应的离子方程式: ___________
(2)a的值为__________
(3)求出原混合物各成分的物质的量(要求写出计算过程)
(1)近年来,我国用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
C+ K2Cr2O7+ — CO2↑+ K2SO4 + Cr2(SO4)3+ H2O
①完成并配平上述化学方程式。
②在上述方程式上用单线桥标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
(3)向FeCl2和FeCl3混合溶液中加入适量KOH,高速搅拌下加入油脂,过滤后干燥得到一类特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3)。
①若x的平均值为1.3,a:b:c=_____________
②若x为1.4,请写出该磁流体在稀硫酸条件下与足量的KI溶液反应的化学方程式:_________。
(4)Fe3O4溶于稀HNO3的离子方程式:_____________。
(15分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成: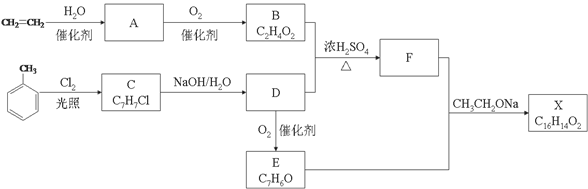
已知:RX ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’  RCH=CHCOOR’
RCH=CHCOOR’
请回答:
(1)E中官能团的名称是 。
(2)B+D→F的化学方程式 。
(3)X的结构简式 。
(4)对于化合物X,下列说法正确的是 。
| A.能发生水解反应 | B.不与浓硝酸发生取代反应 |
| C.能使Br2/CCl4溶液褪色 | D.能发生银镜反应 |
(5)下列化合物中属于F的同分异构体的是 。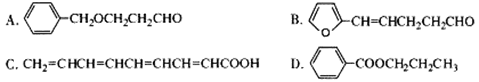
(18分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,请答题:
(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2: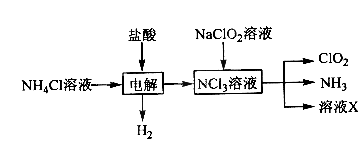
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水b.碱石灰c.浓硫酸d.饱和食盐水
(2)用下图装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g。(相对原子质量Cl35.5O16)
(3)用ClO2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______(填标号)。
a.明矾b.碘化钾c.盐酸d.硫酸亚铁
(21分)过氧化氢常用作氧化剂、漂白剂和消毒剂,可用于甲型H1N1流感消毒,为了贮存运输和使用的方便,工业上采用“醇析法”,将它转化为固态的过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和Na2O2的双重性质,工业“醇析法”的工艺如下:
回答下列问题:
(1)过氧化氢溶液加入二氧化锰的反应化学方程式为_____________。
(2)反应温度控制在0~5 ℃时进行的理由是___________。
(3)稳定剂能相互反应,生成一种不溶物将过碳酸钠粒子包住,该反应的化学方程式为_________。
(4)加入异丙醇的作用是___________。
(5)下列物质不能使过碳酸钠较快失效的是________。
a.FeCl3b.Na2S c.CH3COOHd.NaHCO3
(6)根据题中有关信息,请你提出贮存、运输过碳酸钠晶体中应注意(至少两项):___________。
(7)某同学向酸性高锰酸钾溶液中滴入过量过氧化氢溶液,观察到高锰酸钾溶液褪色,则发生反应的离子方程式为__________。