金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有
(2)金刚烷的分子式为
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应①的产物名称是
(4)已知烯烃能发生如下反应:

请写出下列反应产物的 结构简式:
结构简式:

(5)是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(,,)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],写出所有可能的结构简式(不考虑立体异构):
医用氯化钙 可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为: 
(1)CaCO3与盐酸反应的离子方程式。
(2)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有。滤渣主要成分的化学式。
(3)酸化时加盐酸的目的为:
①,
②防止Ca2+ 在蒸发时发生水解。
(4)为什么蒸发 结晶要保持在160℃:。
结晶要保持在160℃:。
(5)为测定样品中CaCl2 ·2H2O的含量,称取0.7522g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.04mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL。
①通过计算,样品中含CaCl2 ·2H2O的质量分数。
②若所测样品 CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
。
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、NO3-、SO42-、Cl-、HCO3-、Cu2+,取该溶液实验如下:
①取少量该溶液,加几滴石蕊试液, 溶液变红色
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热, 有无色气体产生,后在空气中又变成红棕色
③取少量该溶液 ,加BaCl2溶液, 有白色沉淀生成
,加BaCl2溶液, 有白色沉淀生成
④取③中上层清液,加AgNO3溶
 液, 有白色沉淀生成,且不溶于HNO3
液, 有白色沉淀生成,且不溶于HNO3
⑤取少量该溶液,加NaOH溶液, 有白色沉淀生成,当NaOH过量时沉淀部分溶解
根据上述实验现象判断:
(1)溶液中肯定存在的离子是。
(2)溶液中肯定不存在的离子是。
(3)为进一步确定可能存在的离子,应该补充的实验是。
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为::;
为了吸收该反应中产生的尾气,请选择下列中合适的装置。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器X中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元 素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知: Ksp[Fe((OH)3]≈10-38)然后过滤、浓缩、结晶。
素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知: Ksp[Fe((OH)3]≈10-38)然后过滤、浓缩、结晶。
请回答下列问题:
①方案1中的仪器X名称是。
②方案2为了使铁离子全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3E、Fe2(SO4)3 |
④方案2中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因
。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制 在50℃~60℃不宜过高的原因是
在50℃~60℃不宜过高的原因是
⑥本实验CuSO4·5H2O的产率为。
S2Cl2是一种易挥发的液体(熔点:—76℃,沸点:138℃),且易与水发生水解反应,可能生成H2S、SO2、H2SO3、H2SO4等物质。它是橡胶硫化剂。在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置 (夹持装置、加热装置均已略去)。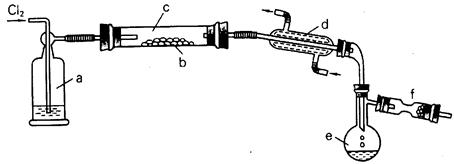
(1)已知S2Cl2分子结构与H2O2相似,则S2Cl2的分子中共含有条共价键。
(2)装置a中应放试剂为 ;装置d的名称是 ,它的作用是。
(3)该实验的操作顺序应为 (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2⑤停止加热装置c
(4)图中f装置中应放置的试剂为 ,其作用为。
(5)将S2Cl2的水解气体产物通入氯水中,若观察到的现象,则可证明水解产物中有硫化氢生成。
二氧化硫和氮的氧化物是重要的化工原料,同时也是造成大气污染的主要物质。对其性质的研究是化学的重要任务。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)N2O5在四氯化碳溶液中的分解反应为:2N2O5=4NO2+O2。实验测得在67℃时反应体系中N2O5的物质的量浓度随时间的变化如下表所示。
| t/min |
0 |
1 |
2 |
3 |
4 |
5 |
| c(N2O5)/mol·L—1 |
1.00 |
0.71 |
0.50 |
0.35 |
0.25 |
0.17 |
①实验进行的前1分钟和最后1分钟,用N2O5的物质的量浓度变化表示的平均反应速率分别是、。
②实验进行的最后1分钟,用NO2的物质的量浓度变化表示的平均反应速率是;5分钟时NO2的物质的量浓度是。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中放出的热量为____kJ。