甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1= -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2= -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3= -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。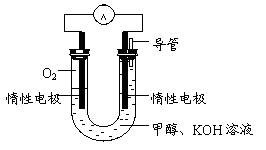
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
(1)氯气可以用于漂白、消毒的原因是因为能与水作用生成具有漂白、消毒作用的_________,相关反应的离子方程式为__________________。
(2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8:00换水,然后通入氯气消毒,通常游泳池中水的含氯量(有效氯)控制在0.5 mg·dm-1至1.0 mg·dm-1之间时,效果最好。右图是该小组测定的每天19:00时游泳池中水的含氯量,哪几天使用游泳池不安全?________________。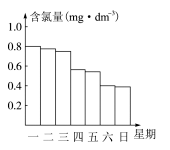
(3)你认为哪几天的天气炎热、阳光强烈____________,说出一种理由__________(必要的方程式和文字)。
(4)小型游泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使用漂白液消毒而非氯气的一项理由_________________;用化学方程式说明工业上如何生产漂白液?_________________。
(1)有四种物质是:①0.5molCO2 ②6gH2 ③1.204×1024个HCl ④147gH2SO4,它们中物质的量最大的是 ,所含分子数最多的是 ,含有原子数最多的是 ,质量最大的是_ (用序号填空)。
(2)配制100 mL浓度为1 mol·L-1的稀硫酸,需要用98%密度为1.84 g/cm3的浓硫酸 mL。
根据题目要求书写化学用语:
(1)碳酸氢钠的电离方程式 。
(2)钠和水反应的离子方程式 。
(3)符合CO2+2OH—===CO32-+H2O的化学方程式 。
(4)请配平如下的化学方程式:
K2Cr2O7+ HCl ═ KCl+ CrCl3+ Cl2↑+ H2O
浓盐酸在上述反应中体现的性质有
| A.还原性 | B.氧化性 | C.酸性 | D.既有氧化性又有还原性 |
某无色溶液中含有CO32-、K+、NH4+、Ba2+、SO42-、Fe3+中几种离子,今取二份体积各100mL该溶液进行实验。
(1)第一份加入足量氢氧化钠浓溶液,加热,产生的氨气在标准状况下体积为896mL;
(2)第二份加入足量氯化钡溶液,生成沉淀质量为6.27g,再经足量稀盐酸洗涤后得2.33g残渣。
据此回答:
①用稀盐酸洗涤沉淀时反应的离子方程式为 ;
②含有的阴离子及其对应物质的量浓度依次是 ;
③对是否存在K+的判断依据是 。
向烧杯中加25mL蒸馏水,加热至沸腾,立即滴加6滴饱和FeCl3溶液,继续煮沸至溶液呈透明红褐色。冷却后将其净化既成功制得介稳体系R。试回答:
(1)R中分散质直径为 ;
(2)煮沸时反应的离子方程式为 ;
(3)判断该实验成功的实验方法是(填名称) ;
(4)向R中逐滴加入稀硫酸至过量,实验现象是 ,最后得到棕黄色溶液。