下列实验事实中能说明NH3·H2O是弱电解质的正确组合是( )
①氨水能与镁盐作用产生白色沉淀 ②氨水溶液中只有少量OH— ③NH4Cl溶液显酸性④0.1mol/L氨水溶液pH=11 ⑤NH3·H2O只能部分电离产生NH4+和OH—
| A.①②③ | B.②③④ | C.③④⑤ | D.①②③④⑤ |
下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿中。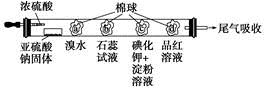
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是
| 选项 |
现象 |
解释或结论 |
| A |
a处黄色褪去 |
非金属性:Br>S |
| B |
b处变为红色 |
二氧化硫与水反应生成酸性物质 |
| C |
c处变为蓝色 |
二氧化硫具有一定的氧化性 |
| D |
d处红色先褪去后恢复 |
二氧化硫具有漂白性且漂白性不稳定 |
下列说法正确的是
| A.SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色 |
| B.SiO2是酸性氧化物,能与NaOH溶液反应 |
| C.紫色石蕊试液滴入SO2水溶液中,先变红后褪色 |
D.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有 |
下列与实验相关的叙述正确的是
| A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 |
| B.将SO2和Cl2按等物质的量比通入品红溶液中,品红很快褪色 |
| C.NO2与H2O反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为2∶1 |
D.检验某溶液是否含有 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
下列化学实验事实及其结论都正确的是
| 选项 |
实验事实 |
结论 |
| A |
将SO2通入含HClO的溶液中生成H2SO4 |
HClO的酸性比H2SO4强 |
| B |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔表面氧化铝熔点高于铝 |
| C |
SiO2可以和NaOH溶液及HF溶液反应 |
SiO2属于两性氧化性 |
| D |
将SO2通入溴水中,溴水褪色 |
SO2具有漂白性 |
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是①过量的锌与18 mol·L-1的硫酸反应;②过量的氢气与少量氮气在催化剂存在下充分反应;③浓盐酸与过量的MnO2反应;④过量铜与浓硫酸反应;⑤过量稀硝酸与银反应;⑥过量稀硫酸与块状石灰石反应
| A.②③④⑥ | B.②③⑤ |
| C.①④⑤ | D.①②③④⑤⑥ |