已知硝酸锏溶液颜色为蓝色.某学校化学课外小组同学们在做铜与浓硝酸、稀硝酸反应的实验中,发现铜和浓硝酸反应后溶液为绿色旦有红棕色气体产生,而铜和稀硝酸反应后溶液为蓝色,产生无色气体.为弄清反应后溶液颜色出现差异的原因,他们进行了实验探究.
【实验】在两支试管中各放入一小块等质量的铜片,分别加人等体积的浓HN03(14 mol•
L-1)和稀HN03(4mol . L-1 ), 立即用蘸有NaOH的棉花封住试管口。充分反应后铜均无剩余。
(1) Cu与浓HNO3反应的离子方程式______________________________
(2) 用蘸有NaOH的棉花封住试管口的原因________________
【提出假设】假设一、因为铜离子浓度大造成的。
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
【设计实验方案,验证假设】
(3) 上述实验________(“能”或“不能”)证明假设一不成立,原因________________
(4) 甲同学设计实验验证假设二,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
【分析推理】
(5)铜和稀硝酸反应后溶液为蓝色的原理_______________ _
某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题: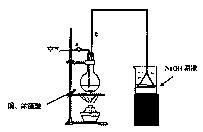
(1)烧杯中用NaOH溶液吸收的物质是:(填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的(填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行____、、后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:,
。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~10nm之间).下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题.
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接,接,接h;
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是,试写出制纳米级碳酸钙的离子方程式;
(3)在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)_____________________________,
(4)取反应后去除CaCO3的溶液分别做以下实验,下列实验判断合理的是:_________.
| A.滴加少量Na2CO3溶液,若有沉淀说明CO2一定不足. |
| B.滴加少量盐酸,若有气泡,CO2一定过量. |
| C.测量溶液pH,若小于7,CO2一定过量 |
| D.滴加少量BaCl2溶液,若无沉淀,CO2一定没有过量. |
(5)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级.
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
(1)原溶液中肯定存在的离子是________________,肯定不存在的离子是____________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________.
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式①H++OH-=H2O
②
③
④HCO3-+H+=H2O+CO2
⑤
某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验 ,写出每一实验鉴定离子的结论与理由。
,写出每一实验鉴定离子的结论与理由。
实验①________________________________________。
实验②_______________________________________。
实验③____ ____________________________________。
____________________________________。
实验④________________________________________。
实验⑤________________________________________。
(2)上述5个实验不能确定是否的离子是___________________。
实验室用氯化钠固体配制1 的NaCl溶液0.5L,回答下列问题:
的NaCl溶液0.5L,回答下列问题:
(1)请写出该实验的实验步骤:
①计算,②,③,④,⑤洗涤,⑥,⑦摇匀。
用托盘天平(指针向上的)称量样品时,若指 针偏向右边,则表示()
针偏向右边,则表示()
| A.左盘重,样品轻 | B.左盘轻,砝码重 |
| C.右盘重,砝码轻 | D.右盘轻,砝码重 |
需要NaClg,实际用托盘天平称量的质量是g。
(2)所需仪器除托盘天平,还需要哪些玻璃仪器才能完成该实验,请写出:、、、。
使用容量瓶前必须进行的操作是。
(3)从该溶液中取出50mL,其中NaCl的物质的量浓度为。