某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
Ⅰ探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与 (填装置编号)连接;装置C中的烧瓶内固体宜选用 。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是 。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入 ,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 。
Ⅱ探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是 。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式 。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为 ;F的烧杯所起的作用是 。
草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
化学性质 |
| H2C2O4 |
189.5℃ |
有毒,具有腐蚀性,易溶于水,二元弱酸。 100℃开始升华,157℃时开始分解。 草酸与浓硫酸混合加热产生CO2、CO和H2O。 草酸钙和草酸氢钙均为白色不溶物 |
[实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸的受热分解产物中含有CO2和CO(部分夹持仪器和加热装置省略)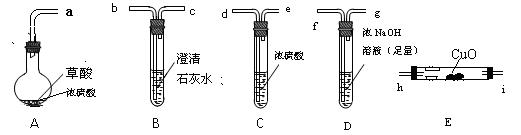
(1)用字母表示接口的正确连接顺序。
a→b→c→( )→( )→d→e→( )→( )→( )→( )→尾气处理
(2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,原因是;请你提出改进意见。
(3)利用改进后装置进行的实验时,要先加热装置,(填“A”、“B”、“C”、“D”、“E”,下同)后加热装置;能证明分解产物中有CO的实验依据是。
[实验二] 探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有。
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下的对比实验:
| 实验序号 |
H2C2O4(aq) |
KMnO4(H+)(aq) |
MnSO4(S) (g) |
褪色时间 (S) |
||
| C(mol·L-1) |
V(mL) |
C(mol·L-1) |
V(mL) |
|||
| 实验1 |
0.1 |
2 |
0.01 |
4 |
0 |
30 |
| 实验2 |
0.1 |
2 |
0.01 |
4 |
5 |
4 |
该对比实验的结论是。
为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
(1)实验目的:分析铁与浓硫酸在加热条件下的反应。
①洗气瓶中浓硫酸的作用是。
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式。
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生, 为进一步确认气体的成分还需要进行进一步的实验。
为进一步确认气体的成分还需要进行进一步的实验。
(2)实验目的:检验气体的成分。
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰。
仪器如下图(可重复使用,可根据需要取用);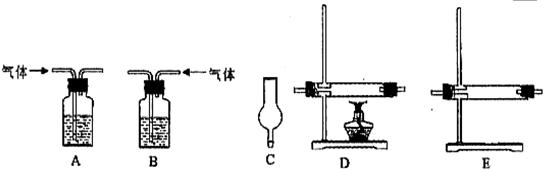
①连接仪器。将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是。
(3)实验目的:确定产物的含量。
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有。
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe3+可采用的试剂为;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为mol。
实验室用燃烧法测定三聚氰胺(CxHyNp)的分子组成.取一定质量的三聚氰胺放在纯氧中充分燃烧,生成CO2、H2O和N2.实验装置如题29图所示(假设每步都完全反应)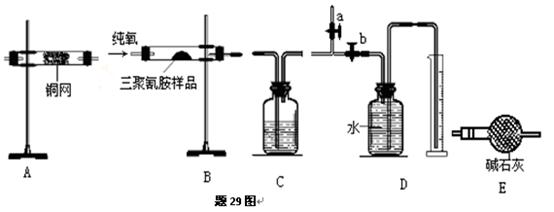
请回答下列问题:
(1)装置的连接顺序是接接接接(填字母).
(2)装置C中盛装的试剂是.
(3)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是
.
(4)以上装置中需要加热的有(填装置字母代号),操作时应先点燃处的酒精灯.
(5)装置A的作用是.
(6)实验中测得氮气的体积(折算到标况下),生成CO2的质量和水的质量,为了确定三聚氰胺的分子式,还需要的数据是.
为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1 mol·L-1的KI溶液,滴加0.1 mol·L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为_____________、。
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想。
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
| 实验操作 |
现象 |
结论 |
| 步骤一: |
产生蓝色沉淀 |
|
| 步骤二: |
“猜想二”成立 |
②写出操作“步骤一”中发生反应的离子方程式
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)
图A中液面所示溶液的体积为mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是(填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。 | |
| B.用待测定的溶液润洗酸式滴定管。 | C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终?。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”),原因是。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位)mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2 Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
___________________________________________________________________
_________________________________________________________________________