某化学实验小组用如图所示的装置制取乙酸乙酯,并检验乙 酸 乙 酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略)。已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃。请根据要求填空:
⑴写出实验室用冰醋酸和无水乙醇制乙酸乙酯的化学方程式:
__________________ 。
⑵为使反应物充分反应,以下措施中正确的是 (填写对应序号)。
①先小火温热,再慢慢升温至微沸状态 ②先大火加热至沸腾状态,并持续加热保持沸腾状态 ③使用稀硫酸作催化剂 ④作用浓硫酸作催化剂
⑶如果单孔塞上的导管短一些,对乙酸乙酯的收集有何影响,简述原因。
答: 。
⑷A同学将收集到的乙酸乙酯滴入含有少量酚酞的NaOH溶液中并在水浴中温热,发现溶液的红色逐渐变浅,由此得出乙酸乙酯中含有乙酸的结论,你认为这一结论正确吗?为什么?
答: 。
⑸B同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是 ,该过程中发生反应的化学方程式是 。
⑹C同学将收集到的乙酸乙酯缓缓滴入饱和Na2CO3溶液中,无气泡产生,于是得出该乙酸乙酯中不含乙酸的结论。请你运用所学知识,评价该同学的结论是否正确。
我的评价是: 。
某校课题研究小组的同学们为了探究“二氧化碳在什么条件下和过氧化钠反应”。甲同学设计了如下的实验探究:
实验一:干燥的二氧化碳和过氧化钠的反应:
在干燥的试管Ⅱ中装入Na2O2,立即塞紧该试管的试管塞(试管塞上两导气管上的K1和K2处于关闭状态),在试管Ⅰ内装入试剂X后,按图连好装置,打开K1和K2,通入CO2。几分钟后,将带火星的木条插入试管Ⅲ中,观察到木条不复燃,且Ⅱ中的淡黄色没有变化。
实验二:潮湿的二氧化碳和过氧化钠的反应:
在试管Ⅰ内装入试剂Y,其他操作同实验一,观察到木条复燃,且Ⅱ中的淡黄色变为白色。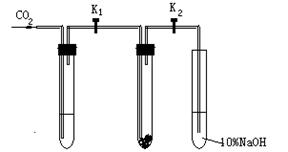
ⅠⅡⅢ
试回答下列问题:
(1)在实验一中,试剂X是,其作用是。
(2)在实验二中,试剂Y是。
(3)在装入Na2O2后,立即塞紧试管塞,且关闭K1和K2的目的是
;
(4)试管Ⅲ中的NaOH溶液的作用是。
(5)根据上述两个对比实验的现象,甲同学得到的结论是:
。
12分) 已知有以下物质相互转化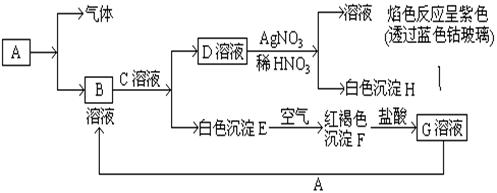
试回答: (1)写出化学式B,DEF
(2)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式 _______。
(13分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如下图(部分反应物已略去)。
请回答下列问题:
(1)E的化学式为_______________(2分)。
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是_______________(2分)。
(3)在反应①②③④中属于置换反应的是__________(填序号)(2分)。
(4)反应②的离子方程式为______________________________________________(2分)。
(5)用石墨作电极电解50mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出电解时的阳极反应式________________________________________(2分)。
②电解后溶液的pH为_______________________________(3分)(假设电解前后溶液体积不变)。
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4 ℃,熔点9.79 ℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式:
__________________________________________________________,
___________________________________________________________。
(2)配制乙醇和浓硫酸混合液的要求和操作要点
。
(3)反应后期a中反应物 混合液的颜色逐渐变黑,请用简要文字和化学方程式说明原因__________________________________________________________________。
混合液的颜色逐渐变黑,请用简要文字和化学方程式说明原因__________________________________________________________________。
(4)瓶b的作用为: ___________________________________________。
(5)容器c、e中NaOH溶液的作用分别是: ______________________
___________________________。
(6)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:_______________________________________________。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·xH2O的化学方程式为▲。
⑵ 检验TiO2·xH2O中Cl-是否被洗净的方法是▲。
⑶配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是▲;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的▲(填字母代号)。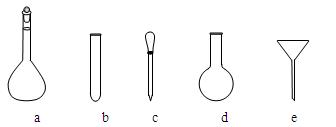
⑷滴定终点的现象是▲。
⑸滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为▲。
⑹判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果▲。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果▲